Общие понятия о растворах. Способы выражения количественного состава растворов. Растворы неэлектролитов. Осмос и осмотическое давление. Закон Вант-Гоффа. Понижение давления насыщенного пара растворителя над раствором. Закон Рауля и следствия из него. Растворы электролитов. Понятие об электролитах. Диссоциация (ионизация) электролитов – сложный физико-химический процесс. Диссоциация кислот, солей и оснований. Сила электролитов. Константа диссоциации и степень диссоциации. Условия смещения ионных равновесий. Закон разведения Оствальда. Ионная сила растворов электролитов. Понятие об активности ионов. Ионное произведение воды, рН и рОН. Индикаторы. Буферные растворы. Произведение растворимости малорастворимых электролитов. Реакции обмена в растворах электролитов: обратимые и необратимые. Гидролиз солей. Типичные случаи гидролиза. Степень гидролиза и константа гидролиза. Влияние различных факторов на гидролиз.
Энергетические эффекты при образовании растворов
|
|
|
Раствор – термодинамически устойчивая однофазная система переменного состава, состоящая из двух или более компонентов. По агрегатному состоянию растворы могут быть газообразными (раствор аргона в азоте), жидкими (раствор соли NaCl в воде), твёрдыми (раствор углерода в железе).
Энергетической характеристикой процесса растворения является энтальпия растворения. Энтальпией растворения называется изменение энтальпии при растворении 1 моль вещества в данном растворителе. Энтальпия растворения зависит от температуры и количества взятого растворителя.
Энтальпия растворения кристаллического вещества DНраств связана с энтальпией разрушения кристаллической решетки (DНразр > 0) и энтальпией гидратации (DНгидр < 0) соотношением
DНраств = DНразр + DНгидр.
Если DНразр > DНгидр, то DНраств > 0. Следовательно, растворение сопровождается поглощением тепла (Qp < 0). При DНразр < DНгидр, DНраств < 0, т.е. при растворении тепло выделяется (Qp > 0). Количество выделенной или поглощённой теплоты можно найти по формуле:
Qp = сmDТ, (1)
где с – удельная теплоемкость раствора, Дж/г×К; m – общая масса раствора, г;
DТ – понижение или повышение температуры раствора, К.
Пример 1. При растворении 10 г NH4Cl в 233 г воды температура раствора понизилась на 2,8 К. Определите энтальпию растворения NH4Cl, считая удельную теплоёмкость раствора равной 4,18 Дж/г×К.
Решение. Находим общую массу раствора: 10 + 233 = 243 г. По формуле (1) находим Qp при растворении 10 г NH4Cl: Qр = 4,18×243(–2,8) = –2844 Дж =
= –2,844 кДж; DН = 2,844 кДж. Молярная масса NH4Cl равна 53,5 г/моль. Следовательно, количество растворённого вещества будет n = 10/53,5 моль. Тогда энтальпия растворения соли равна
|
|
|
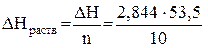 = 15,21 кДж/моль.
= 15,21 кДж/моль.
При растворении многих солей образуются кристаллогидраты. Энтальпию образования кристаллогидрата DН1 можно найти, если известны энтальпии растворения безводной соли DН2 и кристаллогидрата DН3. Тогда
D Н1 = D Н2 – D Н3. (2)
 2015-06-14
2015-06-14 3178
3178







