Задача. Вычислить, какая масса хлората калия KClO3 выкристаллизуется из
50 г насыщенного при 100оС раствора соли, если раствор охладить до
20оС. Растворимость хлората калия при 20оС равна 7,3 г/[100г Н2О],
а при 100о – 56,2 г/[100г Н2О].
Решение: при 100оС раствор содержит 100г воды и 56,2г растворенной соли,
поэтому масса раствора будет 100 + 56,2 = 156,2г. В 50г насыщенного
раствора при 100оС воды будет m(г); составим пропорцию:
в 156,2г раствора воды –100г в 50,0г раствора воды – m(г),
откуда m = 32г, соли 50 – 32 = 18 г. Далее, пусть при 20оС в 32г воды растворится р(г) соли, а по условию задачи, в 100г воды растворяется 7,3г соли. Пропорция: в 32г воды растворится р(г) соли, в 100г воды растворится 7,3г соли, р = 2,3 г, масса соли, выкристаллизовавшейся после охлаждения раствора равна 18 – 2,3 = 15,7 г. Ответ: 15,7 г.
Задача Ск. мл 0,2M раствора NaCl надо добавить к 150 мл 0,16H раствору
AgNO3, чтобы осадить все находящееся в растворе серебро.
Решение: 1×NaCl + 1×AgNO3 = 1×AgCl + 1×NaNO3;
H(NaCl)×V(NaCl) = N(AgNO3)×V(AgNO3) H – нормальность раствора. Нормальность NaCl равна молялрной концентрации соли:
|
|
|
0,3×Vx = 0,16×150; Vx = 80 ml
Задача. Вычислить объем 0,1М раствора карбоната натрия (Na2CO3),
необходимого для осаждения ионов кальция (Са2+) из раствора,
содержащего 0,324 г гидрокарбоната кальция Са(НСО3)2
Решение: Na2CO3+ Са(НСО3)2= 2NaHCO3 + CaCO3↓
Чтобы реакция протекала до конца, необходимо, чтобы 1 моль
Na2CO3 (106 г) прореагировали с 1 молем Са(НСО3)2 (162 г). Для 0,324 г
Са(НСО3)2 потребуется Х(г) Na2CO3: из пропорции 106↔162 X ↔ 0,324
X=0,212 г. Для осаждения 0,324 г ионов Са2+ потребуется 0,212 г Na2CO3
В 1 литре 0,1М раствора щелочи → 10,6 г Na2CO3
в V(л) “ должно быть → 0,212 г
V = 0,02 л = 20 мл. Ответ: 20 млl.
Задача. Вычислить массу осадка, выпадающего при слиянии 40мл 25%
раствора NaOH (ρ = 1,27г/мл) и 60мл 0,5M раствора FeCl3.
Решение: 1FeCl3 + 3NaOH = 1Fe(OH)3↓ + 3NaCl;
M[FeCl3] = 161; M[NaOH]=40; M[Fe(OH)3]=107
На основании закона эквивалентности, для компонентов реакции должна
выполняться пропорция: V1×H1 = V2×H2, где V и Н – объём и нормальность соответствующего раствора. Вычислим V×H для раствора щелочи. V = 40 мл,
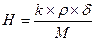 ; для NaOH k = 1, ρ = 1270 г/л, δ=0,25, М=40. Н=7,94, H×V ≈ 318
; для NaOH k = 1, ρ = 1270 г/л, δ=0,25, М=40. Н=7,94, H×V ≈ 318
Для соли FeCl3 V = 60 ml, k = 3, H = k×C = 1,5. H×V = 90; следовательно,
щелочи взято с избытком и pасчёт теперь поведем по FeCl3. Из уравнения реакции следует, что если в реакции расходуется 1 моль FeCl3, в осадок выпадает 1 моль Fe(OH)3 Вычислим, ск. молей соли прореагировало: n = m/M = C×V = 0,5×0,06 =
0,03 моля, значит, в осадок выпадет 0,03×107 = 3,21г Fe(OH)3. Ответ: 3,21 г.
Задача. Вычислить массу осадка, который образуется при сливании 20мл
BaCl2 и 15мл 0,2M раствора серной кислоты H2SO4.
Решение: BaCl2 + H2SO4 = BaSO4↓ + 2HCl Чтобы реакция протекала до конца, необходимо выполнение пропорции: 20×Н = 15×0,1; H(BaCl2) = 0,075;
|
|
|
C(BaCl2) = 2×0,075 = 0,15 моль/л. Следовательно, образуется 0,15 моля BaSO4. В 20мл 0,15M раствора масса BaSO4 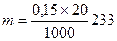 =0,699 г.
=0,699 г.
Задача. Вычислить массу осадка, который образуется при слиянии 30 мл
0,1M раствора CaCl2 и 20мл 0,2M раствора (NH4)2C2O4
M[CaCl2] = 110, M[(NH4)2C2O4] = 144, M[CaC2O4] = 128
Решение: CaCl2 + (NH4)2C2O4 = CaC2O4↓+ 2NH4Cl; вычислим число молей CaCl2 в 30 мл раствора: 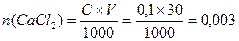 . Число молей (NH4)2C2O4 в 20 мл раствора
. Число молей (NH4)2C2O4 в 20 мл раствора 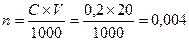 , т.е. (NH4)2C2O4 в избытке, следовательно, расчет следует вести по CaCl2; В реакции хлорида кальция прореагировало 0,003 моля, CaC2O4 образовалось так же 0,003 моля или 0,003×128 = 0,384 г = 384 мг.
, т.е. (NH4)2C2O4 в избытке, следовательно, расчет следует вести по CaCl2; В реакции хлорида кальция прореагировало 0,003 моля, CaC2O4 образовалось так же 0,003 моля или 0,003×128 = 0,384 г = 384 мг.
 2015-06-05
2015-06-05 3008
3008








