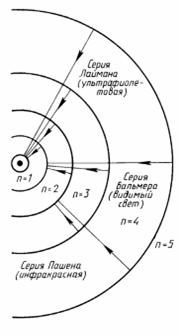
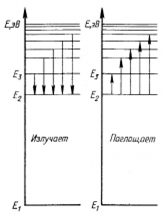
В середине XVIII в. Г. Кирхгоф обнаружил: свечение газов дает четко выраженные дискретные линии.
Швейцарский преподаватель И. Бальмер эмпирически вывел формулу для спектра водорода (1885): 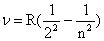 , где n – любое целое число >2, т. е. п=3, 4, 5 и т.д.
, где n – любое целое число >2, т. е. п=3, 4, 5 и т.д.
Величина R носит название "постоянная Ридберга"
Для инфракрасной области спектра аналогичную формулу вывел Ф. Пашен:
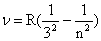 ,
,
где n – любое целое число >3, т. е. п=, 4, 5 и т.д.
А для ультрафиолетовой – Т. Лайман 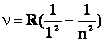 , где n – любое целое число >1, т. е. n=2,3, 4, 5 и т.д.
, где n – любое целое число >1, т. е. n=2,3, 4, 5 и т.д.
Значения длин волн спектральных линий, вычисленных по этим формулам, совпадали с исключительной точностью со значениями длин волн этих линий, измеренных экспериментально. В конце XIX в. ученые обнаружили фундаментальную закономерность в микромире, которую в то время объяснить не смогли.
Только через 30 лет Н. Бор дал физическую интерпретацию этой формулы.
Он предположил, что два члена в формуле Бальмера представляют собой полные энергии разрешенных орбит электрона в атоме водорода.
Преобразовав формулу Бальмера (умножив обе части на h), получим:
|
|
|
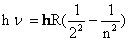
Учитывая, что согласно гипотезе Планка энергия кванта Δ 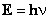 , получим:
, получим:
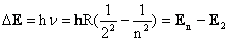
Свои постулаты Н. Бор применил для построения теории атома водорода.
 2015-06-05
2015-06-05 714
714








