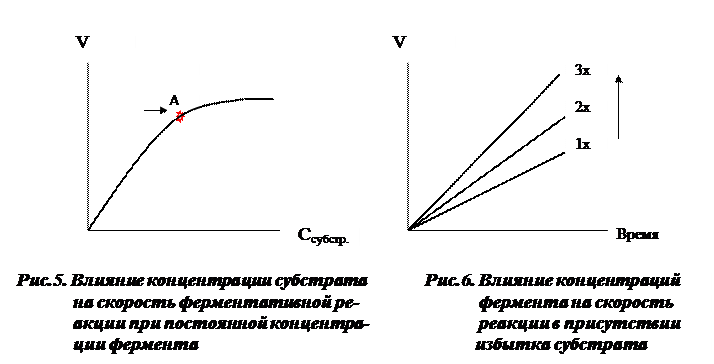
Влияние концентрации фермента и субстрата на скорость ферментативной реакции представлено на рис. 5 и 6. При постоянной концентрации фермента скорость реакции при повышении концентрации субстрата увеличивается до достижения определенного максимума (т.А на рис. 5). Это состояние насыщения субстрата ферментом. Дальнейшее увеличение концентрации субстрата не приводит к изменению скорости реакции.
С повышением концентрации фермента при избытке субстрата скорость реакции линейно возрастает (рис. 6).

Количественное соотношение между концентрацией субстрата и скоростью ферментативной реакции выражается уравнением Михаэлиса-Ментена:
Vmax ∙ [S]
 V =, (1)
V =, (1)
Ks + [S]
где V – наблюдаемая скорость реакции при данной концентрации субстрата
[S];
Vmax – максимальная скорость реакции при полном насыщении фермента
субстратом;
Ks – константа диссоциации фермент-субстратного комплекса, моль/л;
Ks вычисляют по формуле: [E] ∙ [S], (2)
 [ES]
[ES]
где [E], [S], [ES] – молярные концентрации фермента, субстрата и
|
|
|
фермент-субстратного комплекса, моль/л.
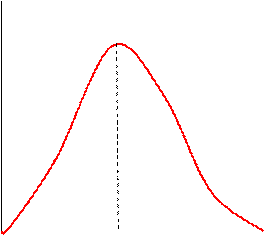
Зависимость активность фермента от температуры дана на рис. 3. Линейное увеличение скорости ферментативной реакции от температуры наблюдается в области 5-25 о С. При дальнейшем повышении температуры скорость увеличивается до определенного максимального значения, а затем происходит ее снижение вследствие тепловой денатурации фермента. Для большинства ферментов температурный оптимум лежит в области 37-40 о С (рис. 3).
 | |||
 | |||


 t o C
t o C

 10 37 50 70
10 37 50 70
 2015-06-26
2015-06-26 319
319








