Обратимые ингибиторы связываются с ферментом слабыми нековалентными связями и при определённых условиях легко отделяются от фермента. Обратимые ингибиторы бывают конкурентными и неконкурентными
-Конкурентное ингибирование В этом случае ингибитор связывается в активном центре фермента и конкурирует за него с субстратом. Конкурентный ингибитор обычно структурно схож с субстратом, однако фермент не способен катализировать реакцию в присутствии ингибитора из-за отсутствия у последнего необходимых функциональных групп. Неконкурентное ингибирование
Неконкурентный ингибитор не мешает связыванию субстрата с ферментом. Он способен присоединяться как к свободному ферменту, так и к фермент-субстратному комплексу с одинаковой эффективностью. Ингибитор вызывает такие конформационные изменения, которые не позволяют ферменту превращать субстрат в продукт, но не влияют на сродство фермента к субстрату.
Необратимое ингибирование наблюдают в случае образования ковалентных стабильных связей между молекулой ингибитора и фермента. Чаще всего модификации подвергается активный центр фермента, В результате фермент не может выполнять каталитическую функцию.Пример лекарственного препарата, действие которого основано на необратимом ингибировании ферментов, - широко используемый препарат аспирин. Противовоспалительный нестероидный препарат аспирин обеспечивает фармакологическое действие за счёт ингибирования фермента циклооксигеназы, катализирующего реакцию образования простагландинов из арахидоновой кислоты. В результате химической реакции ацетильный остаток аспирина присоединяется к свободной концевой NH2-группе одной из субъединиц циклооксигеназы.Это вызывает снижение образования продуктов реакции простагландинов, которые обладают широким спектром биологических функций, в том числе являются медиаторами воспаления.
|
|
|
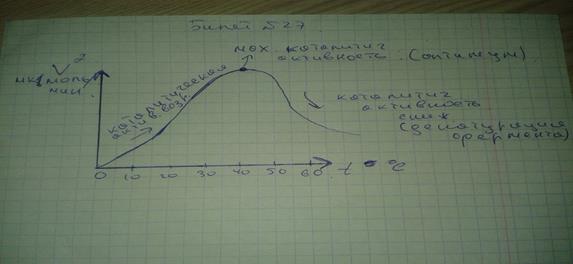
2. С повышением температуры ускоряется движение молекул, что приводит к повышению вероятности взаимодействия реагирующих веществ и повышению энергии веществ, за которым следует ускорение каталитической активности, но при высоких температурах происходит денатурация ферментов. Что приводит к снижению скорости катализа.
3. FAD может быть восстановлен до FADH2, при этом он принимает два атома водорода.
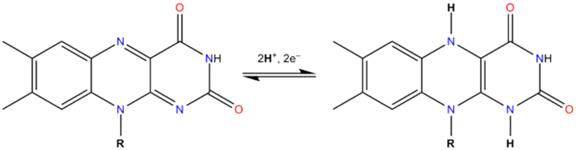
К числу ферментов дыхательной цепи относятся - флавинзависимые дегидрогеназы (флавопротеиды), у которых простетической группой служат ФМН и ФАД.
Амилаза слюны относится к классу гидролаз. Субстратом амилазы слюны является крахмал и гликоген Амилаза слюны катализирует 1,4 гликозидные связи.Специфичность амилазы слюны обусловлена особой формой молекулы фермента, точно соответствующей форме молекулы субстрата. Определить специфичность амилазы слюны можно.Для этого нужно взять 2 субстрата- крахмал и сахарозу и добавить туда разбавленную слюну и поставить в термостат, затем провести пробу Тромера. Пробирка в которой находится крахмал расщепляется амилазой слюны, а в пробирке с сахарозой расщепления не происходит, вследствие чего можно сказать. Что она не является спец. Субстратом для амилазы слюны.
|
|
|
5. Для объяснения механизма окислительного фосфорилирования выдвигалось много гипотез.
Общепринятой в настоящее время является хемиосмотическая теория, предложенная Митчеллом в 1961 году.
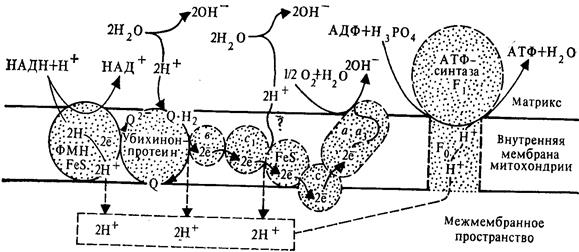
Рис. 3. Схема сопряжения дыхания и фосфорилирования согласно хемиосмотической теории.
1. Процесс протекает на внутренней мембране митохондрий, где располагается дыхательная цепь ферментов.
2. Внутренняя мембрана непроницаема для протонов (и большинства катионов). Это свойство обусловливает возможность неравномерного распределения заряженных частиц по обе стороны мембраны. Движение протонов и электронов имеет строго определенную направленность.
3. Ферменты-переносчики дыхательной цепи располагаются в мембране зигзагообразно. Они способны не только акцептировать атомарный водород от окисляемых субстратов, но и транспортировать его в поперечном направлении через мембрану. Достигая противоположного (внешнего) слоя мембраны, переносчик освобождает в водное пространство снаружи от нее протоны, а электроны при участии дополнительных переносчиков направляются обратно к внутреннему слою мембраны и передаются очередному ферменту дыхательной цепи. Для восстановления ферментам кроме электронов нужны протоны, которые поступают из внутреннего пространства за счет вынужденной диссоциации воды. Всего при переносе пары электронов (от НАД.2Н) по дыхательной цепи происходит выталкивание в межмембранное пространство трех пар протонов.Таким образом, протоны транспортируются от внутреннего слоя мембраны со стороны матрикса к наружному со стороны межмембранного пространства, а электроны передаются по цепи ферментов, достигая конечного акцептора электронов – кислорода
4. В результате такого перераспределения электрических зарядов со стороны матрикса внутренняя мембраны оказывается заряженной отрицательно и щелочной (в ней накапливается избыток ОН- -ионов за счет реакции (1) и остающихся ОН- от диссоциации воды в матриксе), а со стороны межмембранного пространства - заряженной положительно и более кислой (за счет транспорта протонов). Возникает электрохимический протонный градиент, в форме которого на замкнутой мембране и происходит концентрация энергии.
Из-за разницы в концентрации и электрическом потенциале на протоны, находящиеся в наружном пространстве, действует сила, стремящаяся перевести их через мембрану во внутреннее пространство.
5. ^ Возвращение протонов в матрикс осуществляется с помощью фермента аденозинтрифосфатазы (АТФ-азы или АТФ-синтазы). Этот фермент встроен во внутреннюю мембрану. Возникающие изменения в мембране (электрохимический потенциал) передаются АТФ-синтазе, которая активизируется и катализирует синтез АТФ. Таким образом, окислительное фосфорилирование – синтез АТФ из АДФ и неорганического фосфата за счет энергии электрохимического потенциала.
 2015-06-26
2015-06-26 1231
1231








