Все расчеты в термодинамике основываются на использовании функций состояния, называемых термодинамическими потенциалами.
Каждому набору независимых параметров соответствует свой термодинамический потенциал.
Изменения потенциалов, происходящие в ходе каких-либо процессов, определяют либо совершаемую системой работу, либо получаемое системой тепло.
При рассмотрении термодинамических потенциалов мы будем пользоваться соотношением 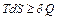 . (12)
. (12)
· Знак равенства относится к обратимым,
· знак неравенства — к необратимым процессам.
Термодинамические потенциалы являются функциями состояния.
Поэтому приращение любого из потенциалов равно полному дифференциалу функции, которой он выражается.
Полный дифференциал функции f (х, у) п еременных x и у определяется выражением
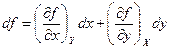 .
.
Поэтому, если в ходе преобразований мы получим для приращения некоторой величины f выражение вида 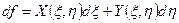 ,
,
можно утверждать, что эта величина является функцией параметров ξ и η, причем функции X (ξ, η) и Y (ξ, η) представляют собой частные производные функции f (ξ, η):
|
|
|
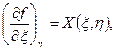
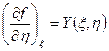 .
.
1) Внутренняя энергия - один из термодинамических потенциалов.
Выражение первого начала для обратимого процесса можно представить в виде

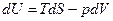 .
.
В качестве так называемых естественных переменных для потенциала U выступают переменные S и V, поэтому
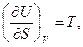
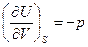 .
.
Из первого начала термодинамики 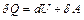 следует, что в случае,
следует, что в случае,
· когда тело не обменивается теплом с внешней средой, совершаемая им работа равна
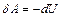
или в интегральной форме:
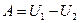 .
.
Таким образом, при отсутствии теплообмена с внешней средой, работа равна убыли внутренней энергии тела.
· При постоянном объеме 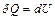 .
.
Следовательно, теплоемкость при постоянном объеме равна
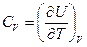 .
.
2) Свободная энергия.
Работа, производимая телом при обратимом изотермическом процессе, может быть представлена в виде
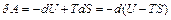 . (13)
. (13)
Функцию состояния 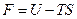 называют свободной энергией тела.
называют свободной энергией тела.
Таким образом, при обратимом изотермическом процессе работа равна убыли свободной энергии тела:
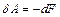 ,
,  (14)
(14)
Или
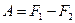 (T = const, обр.). (15)
(T = const, обр.). (15)
При изотермических процессах свободная энергия играет такую же роль, как внутренняя энергия при адиабатических процессах.
Формула (14) справедлива как при обратимых, так и при необратимых процессах.
Формула же (15) справедлива только для обратимых процессов.
При необратимых процессах 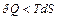 .
.
Подставив это неравенство в соотношение 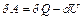 , легко получить, что при необратимых изотермических процессах
, легко получить, что при необратимых изотермических процессах
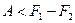 (T = const, необр.).
(T = const, необр.).
Следовательно, убыль свободной энергии определяет верхний предел количества работы, которую может совершить система при изотермическом процессе.
Возьмем дифференциал от функции F:
|
|
|
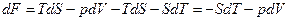 .
.
Естественными переменными для свободной энергии являются Т и V, очевидно
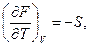
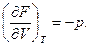
Заменим в (12) d'Q =dU + p dV и разделим получившееся соотношение на dt (t – время).
В результате получим, что
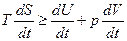 . (16)
. (16)
Если температура и объем остаются постоянными, то соотношение (16) может быть преобразовано к виду
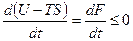
 (T = const, V = const). (17)
(T = const, V = const). (17)
Из этой формулы следует, что необратимый процесс, протекающий при постоянных температуре и объеме, сопровождается уменьшением свободной энергии тела. По достижении равновесия F перестает меняться со временем. Таким образом, при неизменных Т и V равновесным является состояние, для которого свободная знании минимальна.
 2015-06-28
2015-06-28 666
666








