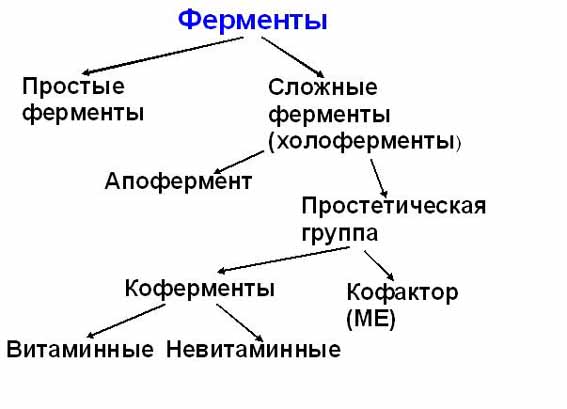
Ферменты, являясь белками, повторяют все особенности структуры и состава белков (состоят из аминокислот, имеют 4 уровня структурной организации), физико-химические свойства белков. Ферменты, как и все функциональные белки, могут быть простыми и сложными.
Простые ферменты представлены только белковой частью (состоят из аминокислот) - пепсин, трипсин, фосфатазы.
Сложные ферменты представлены:
1.Белковой частью (состоит из аминокислот) - апофермент;
2.Небелковой частью.
Небелковая часть может быть представлена:
ионами металлов (К, Na, Ca, Mg, Mn);
коферментами - низкомолекулярные органические вещества.
Для многих ферментов его апофермент вместе с небелковой частью образуют каталитически активную молекулу, которая называется холоферментом.

В роли биокатализаторов могут выступать и небелковые соединения. Рибозимы - биокатализаторы, которые по химической природе являются РНК.
Рибозимы катализируют разрыв фосфодиэфирных связей нуклеиновых кислот.
В пространственной структуре фермента можно выделить отдельные участки, которые выполняют те или иные функции (активный центр, контактный участок, каталитический участок, аллостерический центр).
Активный центр - это участок в молекуле фермента, где происходит связывание и превращение субстрата. Активный центр обычно располагается в гидрофобном углублении (недоступном для молекул воды), изолируя субстрат от воды. В образовании активного центра, участвуют боковые группы АК (12-20 АК), причём эти АК могут находиться на разных участках полипептидной цепи, но при формировании пространственной конфигурации фермента они укладываются т.о., что располагаются в области активного центра. В образовании активного центра принимают участие следующие группы боковых цепей АК:
– NH2 (арг, лиз);
– СООН (асп, глу);
– SH (цис);
– ОН (сер, тре);
– имидазольное кольцо (гис);
– гуанидиновая группа (арг);
– фенольное кольцо (тир).
Остальные АК поддерживают пространственную конфигурацию активного центра фермента
и обеспечивают его реакционную способность.
Контактный (субстрат-связывающий) участок - это место в активном центре фермента, где происходит связывание субстрата с его активным центром. Контактный участок обеспечивает специфическое сродство субстрата к ферменту.
Каталитический участок - место, где проходит сама каталитическая реакция.
Аллостерический центр - участок в молекуле фермента, пространственно удаленный от активного центра. К аллостерическому центру могут присоединяться различные вещества, которые отличаются по структуре от молекул субстрата. Эти вещества называются аллостерические эффекторы. Они могут влиять на конформацию активного центра фермента, изменяя её, т.е. могут или повышать скорость реакции, или тормозить её.
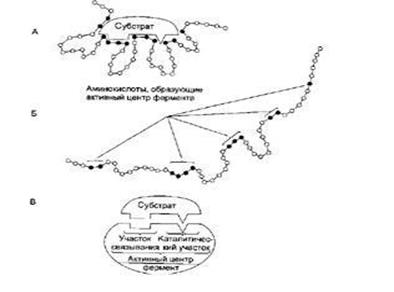

рис. Активный центр фермента
?
| Предыдущий раздел | Раздел верхнего уровня | Следующий раздел |

 2015-06-26
2015-06-26 1962
1962








