Белковая природа ферментов определяет уникальные свойства этих катализаторов:
1. Активность ферментов зависит от температуры. При низких температурах активность ферментов низкая из-за небольшой скорости движения молекул, при этом вероятность встречи фермента с субстратом мала. При повышении температуры активность фермента возрастает. Оптимальные значения температуры для большинства ферментов находятся в пределах 20–40оС. Некоторые ферменты денатурируют уже при температуре около 40оС, но основная часть их инактивируется при температурах выше 40-50оС.
2. Активность ферментов зависит от рН среды. Для каждого фермента существует такая область рН (оптимум), в которой он проявляет максимальную активность. В этой зоне рН конформация фермента максимально соответствует субстрату. При снижении или увеличении рН от оптимума разрушаются связи, построенные на кислотно-основных взаимодействиях (водородные, ионные). Это приводит к изменению конформации фермента, а, следовательно, и активного центра. В результате активность фермента снижается. Таким образом, ацидоз и алкалоз вызывают снижение активности ферментов и, поэтому, опасны для жизни. Для большинства ферментов оптимум рН находится при рН 7,4.
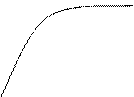

 3. Скорость ферментативной реакции зависит от концентрации субстрата. При низких концентрациях субстрата вероятность столкновения с молекулой фермента мала и образование продукта будет происходить очень медленно. С увеличением концентрации субстрата вероятность столкновения возрастает, скорость реакции увеличивается. Когда активные центры всех молекул фермента заполняются субстратом, скорость реакции становится постоянной (максимальной). Концентрация субстрата, при которой достигается максимальная скорость, называется насыщающей. Концентрация субстрата, при которой скорость реакции равна половине максимальной, называется константой Михаэлиса (Км). Км характеризует сродство фермента к субстрату, то есть способность фермента связывать субстрат. Чем меньше Км, тем выше сродство.
3. Скорость ферментативной реакции зависит от концентрации субстрата. При низких концентрациях субстрата вероятность столкновения с молекулой фермента мала и образование продукта будет происходить очень медленно. С увеличением концентрации субстрата вероятность столкновения возрастает, скорость реакции увеличивается. Когда активные центры всех молекул фермента заполняются субстратом, скорость реакции становится постоянной (максимальной). Концентрация субстрата, при которой достигается максимальная скорость, называется насыщающей. Концентрация субстрата, при которой скорость реакции равна половине максимальной, называется константой Михаэлиса (Км). Км характеризует сродство фермента к субстрату, то есть способность фермента связывать субстрат. Чем меньше Км, тем выше сродство.
4. Зависимость скорости реакции от концентрации фермента.

 v
v
| |||
 |
E
 2015-06-26
2015-06-26 372
372








