Согласно принципу соответствия, вытекающему из правила фаз, каждой совокупности равновесно сосуществующих фаз на диаграмме состояния отвечает свой геометрический образ. По-этому все диаграммы состояния любой сложности содержат одни и те же геометрические элементы.
Правило фаз Гиббса С=к+n-ф для металлических систем из двух компонентов (к=2) при n=1 (из внешних параметров, влияющих на положение равновесия, учитывается только температура) приобретает вид С = 3-Ф
,где С - число термодинамических степеней свободы (вариантность системы);Ф - число конденсированных фаз, находящихся в равновесии.
Рассмотрим возможные случаи.
1. системе одна фаза — ненасыщенный раствор (жидкий или твердый). Тогда Ф=1 и С=2. Система имеет две степени свободы. Это означает, что независимо друг от друга можно изменять, в известных пределах,
значения двух параметров (температуру и состав), и при этом будет существовать одна фаза. Такому условию на диаграмме состояния удовлетворяет поле гомогенности. Поля существования жидких фаз (расплавов) располагаются в верхней части диаграммы и снизу ограничиваются наклонными линиями — линиями насыщения (поля I и II на рис. 1,6; I—III на рис. 1, в; поле V на рис. 2).
|
|
|
Поля устойчивости твердых ненасыщенных растворов примыкают к вертикалям, отвечающим чистым компонентам или химическим соединениям при температурах ниже температур конца кристаллизации. Эти поля сверху (а некоторые снизу) ограничиваются наклонными линиями (поля I—IV на рис. 2).
2. Равновесие двух фаз (две несмешивающиеся жидкости; два твердых раствора или твердый раствор и жидкая фаза). В этом случае Ф=2 и С=1. Система одновариантная. Это значит, что параметры — температура и состав каждой из равновесно сосуществующих фаз— взаимосвязаны одним уравнением. На диаграмме состояния этими уравнениями описываются наклонные линии или линии насыщения одних фаз другими. До этих линий и простираются поля гомогенности. Между линиями насыщения располагается поле гетерогенности — поле устойчивости двух равновесных фаз, в пределах которого число степеней свободы С=1.
Из правила фаз следует, что в смежных полях диаграммы число фаз, а значит и степеней свободы, отличается на единицу. Это следствие облегчает анализ фазовых диаграмм, особенно сложных.
После того, как определены поля гомогенности в любой системе, нетрудно установить, какие фазы существуют в равновесии в любом поле гетерогенности. Ими будут фазы, чьи поля или линии постоянного состава (вертикали) располагаются по обе стороны от рассматриваемого поля гетерогенности. В качестве примера в системе (см. рис. 2) расписаны все поля гомогенности (I—V) и гетерогенности (VI—XIII).
|
|
|
3. Равновесие трех фаз (двух жидких и одной твердой; двух твердых и одной жидкой, либо трех твердых). При этом Ф=3 и С=0. Система безвариантна, т.е. совместное равновесие трех фаз возможно лишь при постоянной температуре и неизменных составах фаз (ни один из параметров произвольно меняться не может). На диаграмме состояния этому удовлетворяет участок горизонтальной линии с тремя точками, указывающими составы равновесных фаз (горизонтальные линии на рис. 1,б;в и на рис. 2).
Например, при температуре точки "Е" (см. рис. 2) горизонталь ДЕF отвечает равновесию трех фаз, составы которых указывают точки "Д", "Е" и "F". В 1-й фазе %В="Д" — это насыщенный 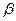 — твердый раствор, так как точка "Д" принадлежит полю II. Во 2-й фазе %В="F" —
— твердый раствор, так как точка "Д" принадлежит полю II. Во 2-й фазе %В="F" —
это кристаллы химического соединения, так как точка "F" находится на вертикали 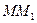 при температуре ТF ниже температуры кристаллизации. В третьей фазе %В=”Е” — это расплав (жидкая фаза).
при температуре ТF ниже температуры кристаллизации. В третьей фазе %В=”Е” — это расплав (жидкая фаза).
Из правила фаз вытекает, что в двухкомпонентной системе одновременно в равновесии не может находиться более трех фаз (число степеней свободы не может быть отрицательным).
Таким образом, двухкомпонентные диаграммы состояния любой сложности — это совокупность полей гомогенности и гетерогенности, разделенных различными линиями:
─наклонными (линии насыщения одних фаз другими);
─вертикальными (линии постоянного состава, отвечающие химическим соединениям);
─горизонтальными (линии равновесного сосуществования трех конденсированных фаз).
Переходя от одного поля к другому, при движении слева на-право, наблюдаем смену полей гомогенности и гетерогенности (см. рис. 2, поля II, VI, V, VII, IV, XI, V, XII, III). При движении сверху вниз в отсутствии горизонтальных линий на диаграмме поля гомогенности и гетерогенности также чередуются (см. рис. 2, поля V, VI, II, IX, I). Если же при таком движении встречаются горизонтальные линии, то выше и ниже них размещаются поля гетерогенности (см. рис. 2, линия ДЕF и поля VI, VII, VIII; линия Д'Е'F' и поля XI, XII, XIII; линия 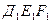 и поля VIII, IX, X).
и поля VIII, IX, X).
4. ЛИНИИ ЛИКВИДУСА И СОЛИДУСА
И ПРИНЦИП НЕПРЕРЫВНОСТИ
Любое чистое вещество кристаллизуется или плавится при постоянной температуре, так как при равновесии двух фаз (жидкой и твердой) число степеней свободы С=0.
Равновесие одной твердой фазы и двухкомпонентного расплава возможно в интервале температур (С=1). Для таких систем различают температуры начала и конца кристаллизации или начала и конца плавления.
Линия, выражающая зависимость температур начала равно весной кристаллизации одной твердой фазы из жидкости (или температур окончательного расплавления твердых фаз) от состава расплава, называется линией ликвидуса. Выше линии ликвидуса — линии насыщения жидкости одной твердой фазой — на диаграмме состояния устойчивы только жидкие фазы (верхняя линия и поле, расположенное выше нее, на рис. 1,а и 2).
В соответствии с принципом непрерывности линия ликвидуса плавная, без точек излома, если в системе только одна твердая фаза
(см. рис. 1,а). При наличии нескольких твердых фаз в системе (см. рис. 2) на линии ликвидуса появляются точки излома, разделяющие ее на ряд ветвей и свидетельствующие об изменении числа и природы фаз.
Если в системе присутствует лишь одна жидкая фаза, то число ветвей ликвидуса совпадает с числом твердых фаз, насыщающих данную жидкость. Например, вещества А и В дают одну жидкую фазу (расплав) и две твердых — кристаллы А и В. Линия ликвидуса на диаграмме состояния такой системы (рис. 3) имеет две ветви СЕ и ЕН с точкой излома "Е".
Выше линии ликвидуса располагается поле I, где устойчив расплав. Ветвь ликвидуса СЕ — линия насыщения жидкости кристаллами А, а ветвь ЕН — линия насыщения расплава кристалла-ми В. Поэтому ниже линии СЕН размещается поле гетерогенности II и III. В каждом из них существуют две фазы — жидкая и твердая.
|
|
|
Жидкость состава точки "Е" насыщена двумя твердыми фазами А и В. Поле существования этих двух твердых фаз и располагается ниже горизонтали ДЕF (механическая смесь).
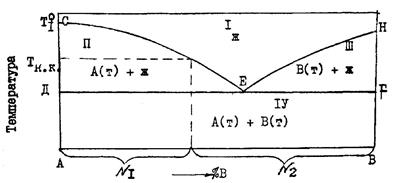
Рис. 3. Диаграмма состояния системы, компоненты которой образуют одну жидкую и две твердые фазы
В системе (см. рис. 2) возможно равновесие расплава с одной из 3-х твердых фаз - раствором 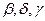 или кристаллами химического соединения М. Поэтому на этой диаграмме три ветви ликвидуса
или кристаллами химического соединения М. Поэтому на этой диаграмме три ветви ликвидуса 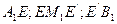 , разделенные несколькими точками излома Е и
, разделенные несколькими точками излома Е и  ,
,
Линия, выражающая зависимость температур конца равновесной кристаллизации или начала расплавления твердых фаз от их состава, называется линией солидуса.
Ниже линии солидуса на диаграмме состояния устойчивы только твердые фазы (см. линию ДЕF и поле ниже нее на рис. 3 и линию 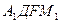 Д'F'
Д'F' 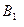 и поля, расположенные ниже нее, на рис. 2).
и поля, расположенные ниже нее, на рис. 2).
5. ХИМИЧЕСКИЕ СОЕДИНЕНИЯ
И ХАРАКТЕР ИХ ПЛАВЛЕНИЯ
Химические соединения, как и простые чистые вещества, плавятся и кристаллизуются при одной и той же температуре, но характер их плавления может быть конгруэнтным и инконгруэнтным.
Если соединение плавится конгруэнтно (без разложения), то состав образующейся жидкости совпадает с составом плавящихся кристаллов. В этом случае на диаграмме состояния (рис. 4) химическому соединению АmВn отвечает вертикаль 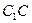 , доходящая до линии ликвидуса.
, доходящая до линии ликвидуса.
Ветви ликвидуса (bC и Cd ) и солидуса (mC и Cn) исходят из
одной экстремальной точки "С", отвечающей температуре плавления (кристаллизации) соединения АmВn.
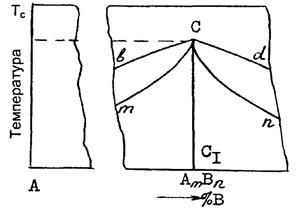
Рис. 4. Участок диаграммы состояния системы с химическим соединением АmВn плавящимся конгруэнтно:
Значит, если соединение плавится конгруэнтно, то на диаграмме состояния при температуре его плавления на линии ликвидуса отмечается отчетливо выраженный максимум (см. рис. 1,в и2). При наличии в системе подобных соединений, сложные диаграммы состояния можно разделить на части, в которых химические соединения будут выполнять роль чистых компонентов. Так, систему F-К (см, рис. 1,в) можно разделить на две частные F-М и М-К, а систему А-В (см. рис. 2) на части А-М и М-В.
|
|
|
Если соединения плавятся инконгруэнтно (с разложением), то
состав образующейся жидкости не совпадает с составом плавящихся кристаллов. В таком случае при температуре плавления происходит распад химического соединения на две фазы - жидкую и твердую, например кристаллы А и жидкость точки PC (см. рис.5)
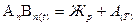 (1)
(1)
Равновесию трех фаз на диаграмме состояния удовлетворяет горизонтальная линия. До нее и будет доходить вертикаль, отвечающая химическому соединению. А линия ликвидуса пройдет выше этой горизонтали (рис. 5) и на ней в точке, отвечающей составу химического соединения, нет максимума.
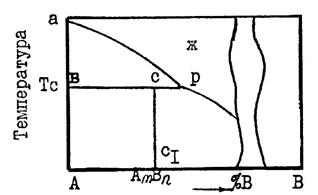
Рис. 5. Участок диаграммы состояния системы с химическим соединением АmВn, плавящимся инконгруэнтно:
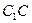 - линия химического соединения АmВn; ар - ветвь ликвидуса; Тс- температура плавления соединения АmВn
- линия химического соединения АmВn; ар - ветвь ликвидуса; Тс- температура плавления соединения АmВn
 2015-07-04
2015-07-04 1387
1387








