Примеры спряженных процессов в пространственно-неоднородных системах.
В пространственно неоднородных системах могут существовать градиенты величин Т, P и др. Поэтому рассмотрение термодинамического сопряжения процессов в таких системах должно учитывать эти градиенты. «Классическими» сопряженными процессами в системах без химических превращений компонентов являются широко обсуждаемые в физике термоэлектрические явления в неоднородных электрических проводниках. Следствием сопряженности термодинамических процессов в таких проводниках являются эффекты Зеебека, Пельтье и Томсона.
Эффектом Зеебека называют возникновение термо ЭДС в замкнутой электрической цепи в случае использования разных металлов и поддержания спаев этих металлов при разной температуре.
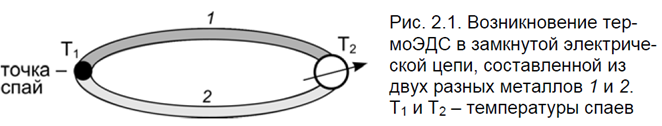
Это явление широко используют, например, для измерения температуры с помощью термопары. Возникновение термоЭДС при этом обусловлено перераспределением носителей тока по проводникам вследствие наличия градиента температуры.
|
|
|
Очевидно, что при взаимодействии потока электронов (электрического тока) и потока теплоты величина термоЭДС т.е. термодинамической силы, обеспечивающей появление тока, оказывается линейной термодинамической силе сопрягающего процесса термодиффузии электрических зарядов, т. е. величине (рис. 2.1).
Эффект Пельтье заключается в выделении или поглощении теплоты на контакте двух проводников разной природы. Эффект нашел практическое применение в специальных холодильниках, в которых охлаждающим элементом является контакт двух специальным образом подобранных полупроводников (рис. 2.2).
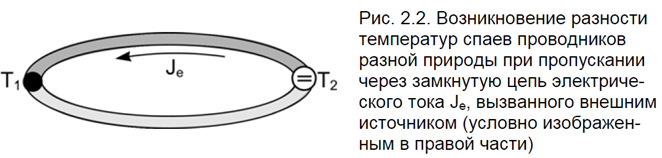
Очевидно, что разность температур спаев в рассматриваемом случае будет пропорциональна току 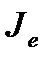 в цепи.
в цепи.
Эффект Томсона заключается в выделении в проводнике дополнительной теплоты (сверх хорошо известной «джоулевой», выделяемой за счет конечного значения электропроводности) за счет совместного действия теплопроводности и электропроводности.
В физической химии примером сопряженных процессов в неоднородных системах являются термохимическийи механокалорический эффекты.
Подобно термоэлектрическому эффекту Зеебека, термомеханический эффектзаключается в возникновении разности давлений 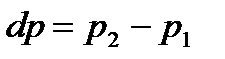 в резервуарах с флюидом (жидкостью или газом), соединенных капилляром, при поддержаниив них разных температур с
в резервуарах с флюидом (жидкостью или газом), соединенных капилляром, при поддержаниив них разных температур с 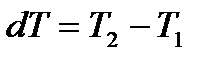 . В случае, когда резервуары отделены один от другого пористой перегородкой,этот эффект называют термоосмосом.
. В случае, когда резервуары отделены один от другого пористой перегородкой,этот эффект называют термоосмосом.
Явление, обратное термомеханическому эффекту, т. е. появление разности температур в результате создания разности давлений в сосудах, называют механокалорическимэффектом.
|
|
|
Рассмотрим причину возникновения и ожидаемую величину термомеханического эффекта. Пусть два сосуда 1 и 2 наполнены некоторым одинаковым флюидом (жидкостью или газом) и связаны между собой капилляром, причем вещество флюида в сосудах поддерживают при заданных постоянных температурах 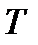 и
и 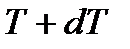 . Обозначим через
. Обозначим через 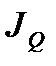 поток энергии, проходящий между сосудами через капилляр, и через
поток энергии, проходящий между сосудами через капилляр, и через 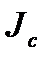 возможный поток вещества флюида, проходящий через этот же капилляр за счет диффузии флюида (рис. 2.3).
возможный поток вещества флюида, проходящий через этот же капилляр за счет диффузии флюида (рис. 2.3).
Термодинамические силы, вызывающие эти потоки, согласно найденным выше соотношениям, определяются выражением
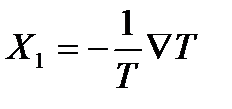 ,
, 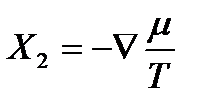 .
.
В соответствии с линейными соотношениями взаимности Онзагера
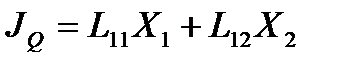
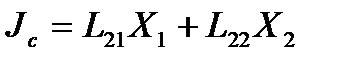
В стационарном по давлению флюида состоянии в рассматриваемой системе поток вещества 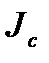 через капилляр равен нулю, но поток энергии
через капилляр равен нулю, но поток энергии 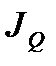 остается постоянной величиной. Поэтому для стационарного состояния указанного типа из приведенных выше формул получаем
остается постоянной величиной. Поэтому для стационарного состояния указанного типа из приведенных выше формул получаем
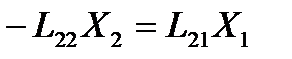
или
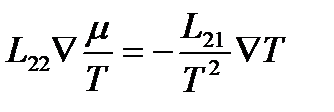 .
.
Отсюда
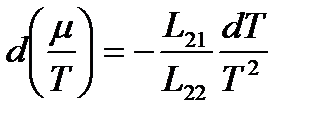 .
.
Для моля однокомпонентного флюида
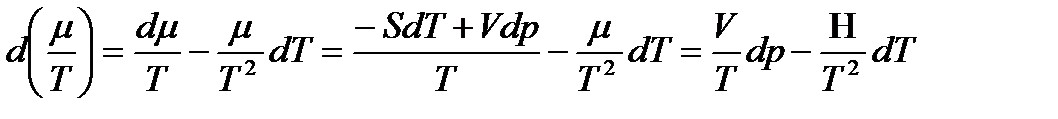 ,
,
где 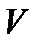 и H – мольные объем и энтальпия флюида, так как в нашем случае
и H – мольные объем и энтальпия флюида, так как в нашем случае 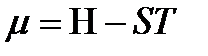 .
.
Из сопоставления обоих выражений для 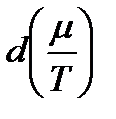 находим
находим
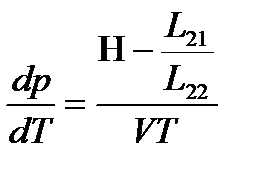 ,
,
или, используя соотношение взаимности Онзагера 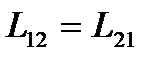 ,
,
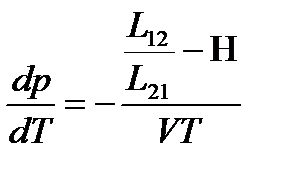 .
.
Из этого выражения видно, что термомеханический эффект будет существовать только тогда, когда молярная энтальпия флюида не равна значению отношения 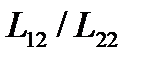 .
.
Для выяснения смысла этого отношения рассмотрим два сосуда при одинаковой температуре (термодинамическая сила 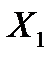 равна нулю). Тогда из уравнений получаем
равна нулю). Тогда из уравнений получаем
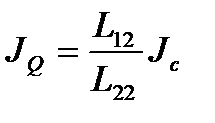 ,
,
т. е. величина 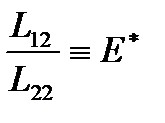 соответствует некоторой «энергии переноса»(количеству энергии, перенесенной единицей массы флюида из первого сосуда во второй при изотермическом процессе).
соответствует некоторой «энергии переноса»(количеству энергии, перенесенной единицей массы флюида из первого сосуда во второй при изотермическом процессе).
При таком переносе энергии температура 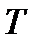 и давление
и давление 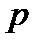 в сосуде 1поддерживаются постоянными за счет поглощения теплоты
в сосуде 1поддерживаются постоянными за счет поглощения теплоты 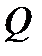 от внешнего источника теплоты и совершения флюидом механической работы. Поэтому изменение внутренней энергии флюида в сосуде 1при вытекании из него моля флюида в соответствии с первым началом термодинамики равно
от внешнего источника теплоты и совершения флюидом механической работы. Поэтому изменение внутренней энергии флюида в сосуде 1при вытекании из него моля флюида в соответствии с первым началом термодинамики равно
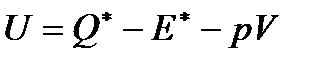 ,
,
откуда
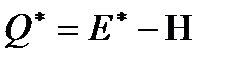 .
.
Теплота 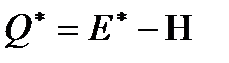 , поглощенная в сосуде 1 молем флюида, перенесенного из сосуда 1 в сосуд 2 при постоянных температуре и разности давлений, называется теплотой переноса.
, поглощенная в сосуде 1 молем флюида, перенесенного из сосуда 1 в сосуд 2 при постоянных температуре и разности давлений, называется теплотой переноса.
Таким образом,
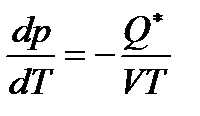 ,
,
и, следовательно, при положительном значении 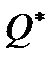 в стационарном состоянии более высокое давление устанавливается там, где более низкая температура.
в стационарном состоянии более высокое давление устанавливается там, где более низкая температура.
В качестве конкретного примера использования уравнения, рассмотрим эффект Кнудсенадля стационарного состояния сосудов с разреженными идеальными газами разной температуры и малым отверстием между ними. Малость отверстия в данном случае означает, что молекулы гораздо чаще сталкиваются со стенками отверстия, чем друг с другом, т. е. реализуется режим кнудсеновской диффузии.
На основании кинетической теории газа легко найти, что энергия переноса 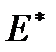 , отнесенная на моль газа, равна
, отнесенная на моль газа, равна
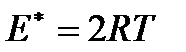 .
.
Действительно, в отсутствие столкновения молекул для движения молекулы через отверстие, находящееся перпендикулярно оси 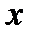 ,
,
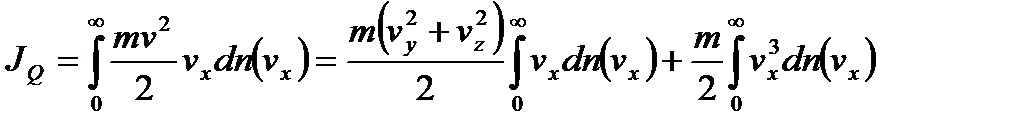 ;
;
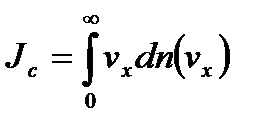 .
.
Здесь 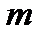 – масса молекулы;
– масса молекулы; 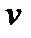 – скорость движения молекулы;
– скорость движения молекулы; 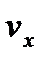 – составляющие этой скорости по соответствующей координате;
– составляющие этой скорости по соответствующей координате; 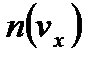 – количество частиц с заданным значением
– количество частиц с заданным значением 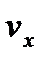 в единице объема. Отсюда
в единице объема. Отсюда
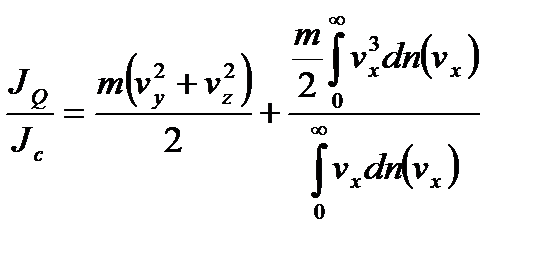 .
.
При наличии распределения Максвелла по скоростям молекул
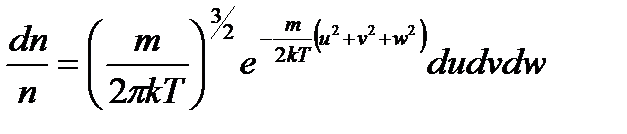 ,
,
и при справедливости интегральных соотношений
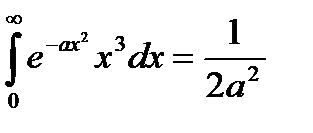 ,
,
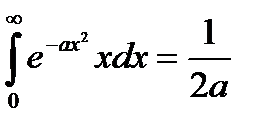
справедливо уравнение
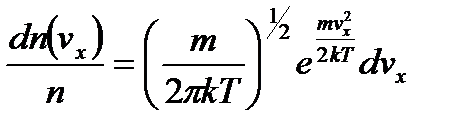
и, следовательно,
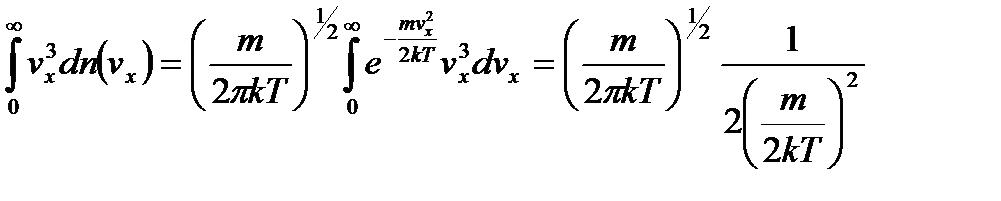 ,
,
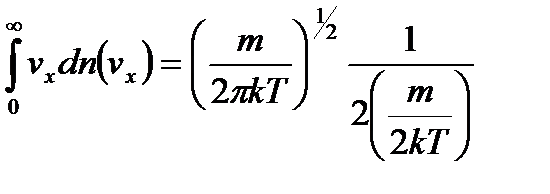 .
.
Поэтому
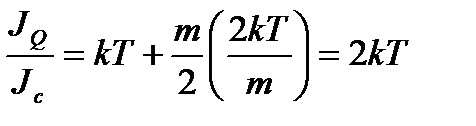 .
.
Поскольку для моля молекул идеального одноатомного газа энтальпия
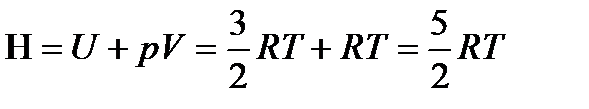 ,
,
теплота переноса для такого газа
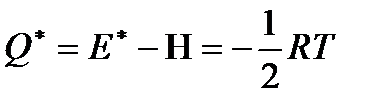
имеет отрицательноезначение.
Считая, что температуры газов в сосудах различаются не сильно и, следовательно, 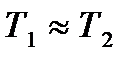 , и подставляя в соотношение
, и подставляя в соотношение 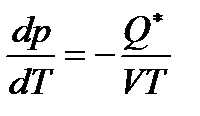 выражение для
выражение для 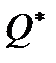 , получаем
, получаем
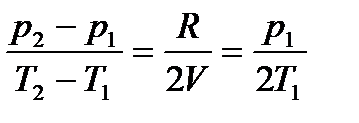 ,
,
или
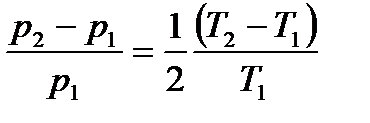 .
.
Таким образом,
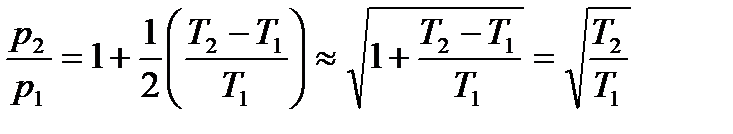 .
.
Отсюда следует соотношение Кнудсена
|
|
|
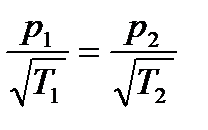 .
.
Данное соотношение говорит о том, что при соединении двух сосудов с разной температурой достаточно узким капилляром (длина свободного пробега молекул больше диаметра капилляра) давление будет больше в том сосуде, которыйгорячее.
В случае идеального газа и большого размера отверстиямежду сосудами, т. е. когда газ проходит через него макроскопическимпотоком, энергия переноса 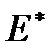 включает кромевнутренней энергии также и работу
включает кромевнутренней энергии также и работу 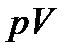 . Поэтому для идеального газа
. Поэтому для идеального газа
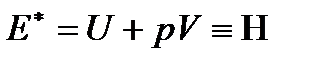 ,
, 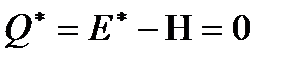 ,
,
откуда
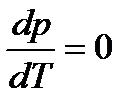 ,
, 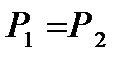 .
.
Таким образом, термомеханический эффект в случае отверстий большого размера не наблюдается.
39. Охарактеризовать термодинамические критерии стойкости стационарных состояний»
При неизменных внешних условиях в неравновесной системе возможно установление стационарного состояния. Особенностью такого состояния является неизменность во времени внутренних параметров системы и как следствие отсутствие потоков внутренних термодинамических параметров, характеризующих состояние системы. Значение этих параметров определяется протекание внутренних необратимых процессов, возбуждаемых внутренними термодинамическими силами.
Например, в стационарном состоянии открытой химически реакционноспособной системы постоянны во времени концентрации интермедиатов, устанавливающиеся за счёт внутренних процессов. Таким образом, в стационарном состоянии скорость изменения концентрации промежуточных продуктов-интермедиатов равна нулю. Стационарное состояние системы достигается при определённых соотношениях между скоростями элементарных реакций, ответственных за образование и исчезновение интермедиатов.
Суммарная энтропия открытой системы в стационарном состоянии также постоянна, то есть:
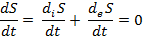
Однако при этом члены deS/dt и diS/dt, соответствующие процессам обмена системы с окружающей средой и внутренними процессами внутри системы, могут быть отличны от нуля.
Существует взаимосвязь между скоростью производства энтропии за счёт самопроизвольных необратимых процессов внутри открытой системы и установление в ней стационарного неравновесного состояния. При этом характер изменения во времени величины diS/dt во многих случаях позволяет установить наличие эволюции открытой системы у стационарному состоянию.
|
|
|
Данная проблема сходна с проблемой классической термодинамики о предсказании направления самопроизвольных необратимых процессов в изолированной системе: согласно второму началу термодинамики, в последнем случае эти изменения происходят только в направлении увеличения энтропии. При этом в конечном равновесном состоянии энтропия достигает своего максимального значения.
Теория термодинамики неравновесных процессов позволяет также ответить на вопрос об устойчивости неравновесных стационарных состояний к внешним возмущениям и самопроизвольным флуктуациям в системе, а также даёт возможность исследовать эту устойчивость путём анализа изменения величины скорости производства энтропии при выводе системы из стационарного состояния.
 2015-07-02
2015-07-02 708
708








