Атом любого элемента состоит из ядра и и электронной оболочки (QA = 0, QЯ = 1,
MЯ = 1). Ядро состоит из протонов (Q = 1) и нейтронов (Q = 0).
Количество протонов равно порядковому номеру элемента. Число нейтронов в ядре
равно разности между массовым числом изотопа и порядковым номером.
Массовое число – сумма количества нейтронов и протонов в ядре. Оно
получается округлением относительной атомной массы изотопа до целого числа.
Атомы одного элемента с разными числами нейтронов в ядре называются
изотопами (Протий – 1p0n, Дейтерий – 1p1n, Тритий – 1p2n, Квадрий – 1p3n).
Число электронов в электронной оболочке равно заряду ядра (или порядковому
номеру элемента). Электроны в атоме различаются энергией, формой электронных
облаков, размерами электронных облаков, расположением их в пространстве.
Устойчивому состоянию ядер атомов соответствуют определенные соотношения чисел
нейтронов и протонов. При нарушении устойчивого протонно-нейтронного
соотношения ядро (а вместе с ним и атом) становится радиоактивным.
|
|
|
Радиоактивность – самопроизвольное превращение неустойчивых атомных ядер в
другие ядра, сопровождающееся испусканием различных частиц. Основными типами
радиоактивного распада являются α-распад и β-распад.
Чем больше расстояние от ядра до электрона, тем выше энергия последнего. Все
электроны с одинаковым запасом энергии образуют один энергетический
уровень. Число энергетических уровней в атоме равно номеру периода.

| 
| 
| 
| 
| |||||
В пределах одного уровня электроны могут иметь различную форму облаков.
Электронное облако – область околоядерного пространства, в которой
вероятность пребывания электрона равна 90-95%. Электроны одного уровня с
одинаковой формой облаков образуют один энергетический подуровень.
Число подуровней на данном уровне равно его номеру.
S P D
F
Электроны одного подуровня различаются расположением электронных облаков в
пространстве. Каждому варианту расположения соответствует одна орбиталь.
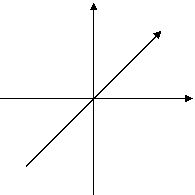
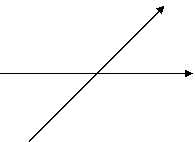
S – 1
P – 3
D – 5
F – 7
S: P:
y y

z z

| |||
| |||
D:
| 
|



| |||

| |||
| 
|



| 
|

Атомы разных элементов с одинаковым числом нейтронов в ядре называются
изотонами (K и Ca). Атомы элементов с одинаковыми массами называются
изобарами.
Каждый электрон в атоме характеризуется четырьмя квантовыми числами: n –
|
|
|
главное, l – орбитальное (побочное), m – магнитное, ms – спиновое. Главное
квантовое число характеризует энергию электронов на данном уровне и размер
электронного облака: чем больше значение n, тем больше энергия электронов и
размер электронного облака. Число n изменяется от 1 до 7. Значение n данного
электрона равно номеру уровня, на котором он находится.
О))))
1 2 3 4
Орбитальное квантовое число характеризует форму электронного облака и
принимает значения от 0 до n–1. Число значений l равно числу подуровней на
данном уровне:
L – 0 1 2 3 4
s p d f g
Магнитное квантовое число характеризует расположение облаков в пространстве
и принимает значения + l..0..- l. Число значений m равно числу орбиталей в
главном подуровне:

S l=0 m=

P l=1 m=

D l=2 m=

F l=3 m=
Спиновое квантовое число характеризует собственный момент количества движения
электрона и принимает значения +1/2 и –1/2. Спин – чисто квантовое
понятие, не имеющее аналогов в макромире. Это собственный момент импульса
электрона, не связанный с движением в пространстве.
Принцип минимальной энергии – атомные орбитали заполняются электронами
последовательно с увеличением суммы n+l:
1s—→2s—→2p—→3s—→3p—→3d—→4s—→4p—U
94;4d—→..
1+02+02+13+03+13+24+04+14+2
1 2 3 3 4 5 4 5
Если сумма n+l для двух орбиталей одинакова, то в первую очередь заполняется
орбиталь с меньшим n.
| 7s | 7p | |||||||||||
| ã | ã | ||||||||||||
| 6s | 6p | 6d | 6f | 6g | 6h | |||||||
| ã | ã | ã | |||||||||||

| 5s | 5p | 5d | 5f | 5g | ||||||||
| У | ã | ã | ã | ||||||||||
 Р Р
| 4s | 4p | 4d | 4f | |||||||||
| О | ã | ã | |||||||||||
| В | 3s | à | 3p | 3d | |||||||||
| Н | ã | ||||||||||||
| И | 2s | à | 2p | ||||||||||
| á | |||||||||||||
| 1s | |||||||||||||

| |||||||||||||
| S | P | D | F | G | H | ||||||||
| П | О | Д | У | Р | О | В | Н | И |
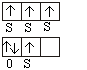
Принцип Паули: в атоме не может быть двух электронов с одинаковыми
значениями их квантовых чисел. Электроны должны различаться одним, двумя или
тремя квантовыми числами обязательно!
Принцип Хунда: суммарный спин подуровня должен быть максимальным по
абсолютной величине.
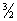
|
2p³:
 Явление проскока электрона наблюдается в атомах Cu, Cr, Mn, Ag, Mo, Nb и др.
Явление проскока электрона наблюдается в атомах Cu, Cr, Mn, Ag, Mo, Nb и др.
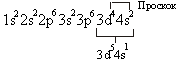 24Cr))))
24Cr))))
s s s s
p p p
d d
f
 2015-07-14
2015-07-14 507
507








