В этом разделе приводится ряд игр, которые можно применять при изучении первоначальных химических понятий, основных классов неорганических веществ.
Данные дидактические игры можно применять как на уроках, так и во внеклассной работе, включая их в программу тематических вечеров или заполняя ими отдельные паузы в ходе мероприятий.
Здесь рассматриваются вербальные, или словесные, игры, которые не требуют долгих приготовлений и сложных атрибутов. Их можно использовать вместо эпиграфа в начале урока, а также на всех последующих этапах обучения. К вербальным дидактическим играм относятся анаграммы, логогрифы, метаграммы, шарады, криптограммы, кроссворды, головоломки, ребусы, загадки и т. д.
Ребусы, загадки, анаграммы, метаграммы, шарады и т. д. учащиеся с большим удовольствием и с пользой для себя могут составлять и сами. Учителю необходимо лишь предварительно показать несколько образцов, а результат творчества учащихся оформить затем в виде стенгазеты в кабинете химии.
|
|
|
Приводятся и игры, требующие для проведения определенной подготовки учеников и специальной атрибутики (карточки, игровые поля, плакаты и т. д.). Вспомогательные средства для игр следует делать красочными. Чтобы обеспечить их многократное использование, карточки необходимо покрыть прозрачным скотчем.
Тема «Первоначальные химические понятия»
Химия – такая есть наука,
И учить её, конечно, скука:
Формулы, законы, элементы,
Уравнения … и прочие моменты.
Из неё, однако, можем мы узнать,
Что, и где, и как взрывать,
Что нельзя нам с вами есть и пить,
Чтобы потом себя не хоронить,
Из чего все вещи, что вокруг.
Они не возникают просто вдруг!
Чтобы это знать и боле,
Учат химию в средней школе.
***
Хочется тебе или не хочется,
Но химиком быть приходится:
Когда еду себе готовишь,
Бельё стираешь или тело моешь,
Квартиру чисто убираешь,
Пищу на зиму «закрываешь» -
Везде химию применяешь.
Химия не хорошая и не плохая,
Человек ведь сам выбирает,
Вредит ли ему химия или помогает.
***
Вещество чистым называется,
Если оно из одинаковых молекул составляется.
Когда молекулы других веществ добавляются,
Тогда уже смеси получаются.
***
Неоднородные смеси легко разделять:
Сначала - отстаивание,
Потом – фильтрование.
Однородные смеси сложнее разделяются:
Выпариваются или перегоняются.
Когда в воде чистой нуждаются,
То дистилляцией занимаются.
«Учим химические элементы»
Рождает воду водород,
Ну а теперь наоборот:
Вода рождает водород,
А заодно и кислород
Не нужен университет,
Ни Кембридж, ни Оксфорд,
Чтобы узнать: латинский «Р»
Обозначает фосфор.
|
|
|
Помни, боевой народ,
Первый лекарь-это йод!
Раны мажь не ойкай,
Йодною настойкой.
Надо сильно попотеть
Вечером и утром,
Чтоб запомнить: слово медь
По латыни «Купрум».
Одинокий, безымянный
Я солдатик оловянный,
Но стоять я не устану.
Так как выплавлен из «Станум».
Новую эру
миру дал «Феррум»,
Очень полезно
людям железо.
Ах, какая аура
Окружает «Аурум»!
Символ власти – кольца
Золота и солнца.
Игры:
«Химическая тайнопись»
Цель игры. Облегчить запоминание названий химических элементов и их символов.
Атрибуты игры. Карточки с названиями химических элементов и их символами.
| Свинец | Na |
| Медь | Mn |
| Золото | J |
| Натрий | Pb |
| Марганец | Au |
| Иод | Cu |
| Магний | K |
| Цинк | Mg |
| Калий | Cl |
| Ртуть | Zn |
| Углерод | Hg |
| Хлор | C |
Задание. Как можно быстрее соедините линией прямоугольники (название элемента) с соответствующими химическими знаками.
«Кто дальше?»
Цель игры. Активизировать процесс запоминания химических элементов и веществ, их деление на металлы и неметаллы, на отдельные классы и т.д.
Задание. Назовите по очереди химический термин (металл, неметалл, название простого вещества или сложного вещества и т. Д.) и сделайте шаг вперед.
Примечание. В игре участвуют одновременно 2-3 ученика - по числу соревнующихся команд. Выигрывает тот, кто прошагает дальше без ошибок и повторений.
«Эстафета расчетных формул»
Цель игры. Совершенствовать память, внимание и закрепить умения учащихся записывать физические и математические формулы, по которым ведется расчеты при решении задач по химии.
Атрибуты игры. Несколько бумажных листочков, сложенных веером по числу играющих команд. На обороте каждой страницы веера написано название физической или химической величины (желательно избегать повтора на одном листе)
Описание игры. Каждая команда (можно оп числу рядов в классе) получает листочек веер. По сигналу игроки, сидящие за перовой партой, раскрывают первую страницу веера и напротив указанной величины пишут формулу, с помощью которой данная величина может быть найдена или рассчитана, и передают веер на следующую парту. Если величина постоянная, то указывают ее значение.
«Руки вверх»
Цель игры. Активизировать внимание учащихся, закрепить понятия «вещество», «физическое тело», развить способности к адекватным реакциям на внешний раздражитель.
Атрибуты игры. Карточки для учителя с перечнем различных веществ и физических тел.
Описание игры. Учитель перечисляет название веществ и физических тел, учащиеся внимательно слушают и смотрят на карточки. Если названо вещество, то учащиеся поднимают руки вверх, а если физическое тело, то руки остаются на парте.
Ученик, допустивший ошибку, дает определение тела или вещества с примерами.
Пример перечня названий:
| Стакан | Кастрюля |
| Гвоздь | алюминий |
| железо | Вода |
| Сахар | Льдина |
| Пластмасса | Соль |
| Ложка | Пробирка |
| Линейка | спирт |
| Крахмал | Мяч |
| Полиэтилен | Уксусная кислота |
| кислород | Дверная ручка |
| мел | лампа |
Примечание. Аналогичные игры можно провести по теме «чистые вещества и смеси», «Физические и химические явления»
.
«Найди ошибку»
Цель игры. Закрепить понятия «простое вещество», «сложное вещество», развить внимание учащихся, выработать умение быстро находить верные и отвергать неверные суждения.
Атрибуты игры. Карточки, на которых написано по 5-6(по числу ученических столов в ряду) строк названий простых и сложных веществ.
| Простые вещества | Сложные вещества |
| 1. хром, сажа, вода | 1. алюминий, сера, хлорид натрия |
| 2. оксид цинка, цинк, иод | 2. хлороводород, фтор, кислород |
| 3. железо, сероводород,медь | 3.оксид цинка, сульфид цинка, вода |
| 4. железо, серная кислота, углекислый газ | 4. фтороводород, хлорид магния, медь |
| 5. хлорид натрия, углекислый газ, водород | 5. поваренная соль, железо, сероуглерод |
| 6. хлор, сульфид цинка, цинк | 6. бром, хлорид натрия, оксид натрия |
| Простые вещества | Сложные вещества |
| 1. сахар, медь, кислород | 1. малахит, золото, серебро |
| 2. сера, хлороводород, магний | 2. графит, оксид натрия, цинк |
| 3. сульфид цинка, вода, водород | 3.железо, поваренная соль, оксид магния |
| 4. натрий, иод, оксид железа | 4. углекислый газ, бромоводород, алюминий |
| 5. сульфид натрия, углерод, ртуть | 5. азот, сульфид кальция, фосфор |
| 6. марганец, хлор, оксид лития | 6.оксид магния, бром, сероуглерод |
| Простые вещества | Сложные вещества |
| 1. кислород, железо, оксид алюминия | 1. сульфид цинка, медь, оксид серебра |
| 2. азот, сероводород, водород | 2. алюминий, графит, оксид натрия |
| 3. сульфид железа, водород, хлор | 3.сера, хлорид натрия. Хлороводород |
| 4. оксид кремния(IV), углерод, цинк | 4. оксид серы(IV), фтор, железо |
| 5. хром, цинк, оксид алюминия | 5. сероуглерод, сульфид железа, кремний |
| 6. иод, медь, сера | 6.оксид ртути, серебро, хлорид серебра |
Описание игры. Учащиеся разбиваются на 3 команды(по рядам столов в классе). Каждая команда получает карточку. Учащиеся вычеркивают или выписывают в тетрадь названия простых и сложных веществ и предают карточку следующему столу
|
|
|
«Физические и химические явления»
Цель игры. Закрепить понятия о признаках химических реакций»
Атрибуты игры. Таблица с признаками реакций
| Физические и химические явления | Признаки | ||||
| Выделение теплоты | Изменение цвета | Запах | Появление осадка | Появление газа | |
| Горение угля | |||||
| Продувание воздуха через известковую воду | |||||
| Диффузия паров духов |
Описание игры. Заштрихуете клетки в таблице с правильными ответами о признаках, сопровождающих явления. Ответом будет изображение римской цифры
Тема «Металлы. Неметаллы»
Цель игры. Закрепить понятия о металлах и неметаллах, простых и сложных веществах, относительной молекулярной массе веществ.
|
|
|
Атрибуты игры. Карточки с формулами элементов
| Знак химического элемента | металл | неметалл |
| C | ||
| Ca | ||
| O | ||
| Al | ||
| N | ||
| H |
Правила игры. Определите природу химического элемента, знаки которых приведены в таблице. Сумма ответов для неметаллов будет равна относительной молекулярной массе гидроксида натрия(NaOH)
«Раздели нас»
Цель игры. Совершенствовать переключение внимания учащихся и наблюдательность. Закрепить знания о химических элементах- металлах и неметаллах.
Атрибуты игры. Карточки, на которых даны в чередующемся порядке строки химических элементов- металлов и химических элементов-неметаллов. Знаки эти перепутаны.
Описание игры. Игроки оп сигналу должны в строке химических элементов- металлов определить и вычеркнуть знаки элементов- неметаллов, а среди химических элементов –неметаллов вычеркнуть элементы- металлы.
| Металлы | Na | K | Mg | O | Ba | Au | P | Cu |
| Неметаллы | Cl | N | C | Ag | O | F | H | Si |
| Металлы | Fe | Ca | Cu | Ba | Br | Si | Pt | Hg |
| Неметаллы | Se | Si | N | F | Na | Ag | Mg | Li |
| Металлы | Cs | Cl | Mn | Cr | K | Cu | Br | F |
| Неметаллы | P | Sn | N | O | H | C | Ca | Mn |
| Металлы | H | Hg | Zn | S | Mg | Cu | P | Br |
| неметаллы | Zn | Ba | He | Fe | J | Pb | Mg | C |
| Металлы | H | Ag | Hg | Mg | Cu | P | Br | S |
| Неметаллы | Zn | Ba | H | Fe | J | Hg | Ne | Mn |
| Металлы | Na | Cl | Pb | Cr | K | Cu | Ar | O |
| Неметаллы | F | Ca | Na | Si | Ba | B | Mg | S |
| Металлы | Cl | N | Na | Cu | Ca | P | Br | Ba |
| Неметаллы | J | F | Fe | F | Au | Ag | He | H |
| Металлы | Ba | Cu | C | Na | N | S | Si | Li |
| неметаллы | S | O | H | He | Na | Fe | F | Cr |
Тема «Типы реакций»
«Дай характеристику»
Цель игры. Отработать понятия реакции разложения и соединения.
Атрибуты игры. Таблица с характеристиками.
| Характеристика реакций | Реакция разложения | Реакция соединения |
| Получается одно новое вещество | ||
| Одно исходное вещество | ||
| получается несколько новых веществ | ||
| несколько исходных веществ |
Описание игры. Дайте правильную характеристику этим реакциям. Если характеристика верна, то сумма чисел равна относительной атомной массе воды(H2O)
К какому типу химических реакций нужно отнести следующие реакции? Из букв, соответствующих правильным ответам, вы получите названия химических элементов.
| Уравнения реакций | Реакции соединения | Реакции разложения | Реакции замещения |
| Zn+2HCl=ZnCl2 +H2 | Ц | Ч | Ф |
| 2Na+S=Na2S | Е | Ё | Ю |
| CaCO3=CaO+CO2 | Т | Р | К |
| N2+3H2=2NH3 | М | Н | О |
| 2Fe(OH)3=Fe2O3+3H2O | Ш | И | Х |
| Mg+CuCl2=MgCl2+Cu | Л | Н | Й |
Тема «Оксиды»
«Крестики нолики»
Цель игры. Обобщить и систематизировать знания о формулах оксидов.
Атрибуты игры. Карточки с формулами веществ.
| HNO3 | SO2 | SO3 |
| CO2 | CuO | MgO |
| O2 | NaOH | ZnSO4 |
| KClO3 | ZnO | Na2O |
| NaOH | SO2 | H2SO4 |
| Cu(OH)2 | N2O3 | CO2 |
Правила игры. Найди выигрышный путь.
«Соотнеси»
Цель игры. Обобщить знания о названии оксидов.
Атрибуты игры. Карточка с формулами и названиями оксидов.
| формулы | названия |
| 1. P4O10 | А) Оксид серы(IV) |
| 2. CO2 | Б)Оксид фосфора(V) |
| 3.SO2 | В)Оксид железа(II) |
| 4 .FeO | Г)Оксид меди(II) |
| 5.K2O | Д)Оксид углерода(IV) |
| 6.CuO | Е)Оксид калия |
«Найди формулы оксидов»
Цель игры. Закрепить знания о составлении формул оксидов
Атрибуты игры. Число карточек по числу оксидов.
| Ca | S | O | O2 | C | Al2 | Mg | O3 | N | Fe2 |
Описание игры. Из предложенных формул составьте формулы оксидов.
«Классификация оксидов»
Описание игры. В каждом ряду один оксид не соответствует следующим признакам:
1. кислотный оксид среди основных
2. основный оксид среди кислотных
3. основный оксид среди амфотерных
а) Na2O,SO2, BaO,K2O
б) NO2,CuO,FeO,CaO
в) SO2, CO2, CaO,CrO3
г) Al2 O3, Na2O, ZnO, Cr 2O3
Тема «Химические свойства оксидов»
«Крестики нолики»
Выигрышный путь составляют оксиды, которые реагируют с водой.
| MnO | ZnO | CaO |
| SO3 | SO2 | Al2O3 |
| Na2O | Ag2O | CuO |
| Fe2O3 | CaO | Al2O3 |
| ZnO | Ag2O | CO2 |
| SO3 | BaO | K2O |
Определите для каждого оксида его свойства. Сумма номеров правильных ответов равна половине относительной молекулярной массе фосфорной кислоты(H3PO4)
| Химические свойства оксидов | оксиды | |||
| K2O | SO2 | SiO2 | CuO | |
| Взаимодействуют с водой | ||||
| Взаимодействуют с основаниями(Щелочами) | ||||
| В результате взаимодействия с водой раствор лакмуса окрашивается в красный цвет | ||||
| Взаимодействует с кислотами |
Определите для каждого оксида характерные свойства. Из букв, соответствующих правильным ответам получите название растворимых в воде оснований.
| Химические свойства оксидов | оксиды | |||
| SiO2 | NO2 | CaO | CuO | |
| Взаимодействуют с с основаниями(щелочами) | щ | е | и | н |
| Взаимодействуют с кислотами | д | и | л | о |
| В результате взаимодействия с водой раствор лакмуса окрашивается в синий цвет | к | а | ч | т |
| В результате взаимодействия с водой раствор лакмуса окрашивается в красный цвет | о | и | р | ы |
Тема «Основные классы неорганических соединений»
«Прятки с формулами»
Цель игры. Развить внимание. Наблюдательность и умение составлять формулы неорганических веществ.
Атрибуты игры. Карточки с формулами веществ, в которых не вписан знак одного химического элемента, входящего в эту формулу.
Описание игры. Найдите элементы. Которые спрятались. Прочитайте формулу и дайте веществу соответствующее название. Задание может быть усложнено тем, что ученик дает сведения о том, к какому классу относится вещество и какими свойствами оно обладает.
| H2…O3 | Na3P… | H2…O4 |
| …CO3 | KO… | …NO2 |
| H…O3 | …OH | H3…O4 |
«Бегунок»
Цель игры. Развить внимание, память и закрепить знания об основных классах неорганических соединений.
Атрибуты игры. Мяч небольшого размера по числу команд.
Описание игры. Игроки выстраиваются друг за другом в один ряд. Ученик, стоящий первый, держит в руке мяч, по команде, например «Кислота» он предает мяч стоящему за ним игроку, называя при этом формулу кислоты и т.д. Консультант следит за правильностью названия формул и чтобы не было повторов. Команды могут касаться любого класса неорганических соединений.
Тема «Генетическая связь между классами неорганических соединений»
«Спринт»
Цель игры. Активизировать процесс запоминания генетических связей неорганических веществ и закрепить умение учащихся составлять уравнения реакций последовательного превращения веществ.
Атрибуты игры. Карточки с формулами неорганических веществ, с помощью которых можно было бы составить генетическую цепочку соответствующего элемента. И несколько формул, не входящих в эти цепочки. Можно воспользоваться свистком для подачи команды «На старт»
|
|
| |||||||
|
|
| |||||||
|
|
|
Описание игры. Двое или более участников должны на столе выбрать карточки для своей генетической цепочки. Составить генетическую цепочку из выбранных карточек. Число звеньев генетической цепочки у участников должно быть одинаковое.
«Отгадайте задуманное простое вещество (химический элемент)»
Цель игры. Развить у учащихся умение определять по характеристике химический элемент или простое вещество.
Атрибуты игры. Карточки с характерными характеристиками.
1. элемент с переменной валентностью
2. высший оксид обладает кислотными свойствами
3. элемент образует несколько аллотропных модификаций
4. реакция с кислородом широко используется в промышленности и быту
5. одно из важнейших соединений элемента используется на всех уроках в школе
6. оксиды играют особую роль в экологии окружающей среды
7. входит в состав всех живых организмов
(углерод)
1. элемент образует простое вещество, хорошо проводящее электрический ток
2. В свободном виде не реагирует с концентрированной серной кислотой
3. гидроксиды элемента нерастворимы в воде
4. находит очень широкое применение, его производят с древних времен
5. при нагревании реагирует с водой
6. соединение элемента входит в состав крови человека им животных
7. в особо чистом виде не подвержен коррозии
8. Одно из соединений называется суриком
(железо)
Описание игры. Участники игры должны максимально быстро определить название соответствующего химического элемента или простого вещества
Тема «Периодическая система Д.И. Менделеева»
1. Представитель от команды называет любой химический элемент периодической системы, участник второй команды должен показать этот элемент и дать ему характеристику по положению в ПС и его свойства. Затем команды меняются заданиями
2. «Все на одну букву»Ведущий предлагает задание: «назовите металлы, которые начинаются на букву «Н» На выполнение задания дается 2-3 минуты
3. «Запиши, запомни»Полоской бумаги ведущий закрывает группу элементов в периодической системе и поочередно предлагает командам назвать и записать знаки элементов закрытой группы или периода.
4. Ведущий предлагает задание: «кто больше составит названий химических элементов из названия элемента по № 91-протактиний.
5. Представители одной из команд имеют четные номера, другой нечетные. Ведущий начинает рассказ о химическом элементе, например с порядковым номером №3 и прерывает его словами: «Теперь рассказ продолжит представитель команды под номером№3.
«Кто лишний?»
Цель игры. Развить внимание, наблюдательность и умение ориентироваться в ПС химических элементов Д.И. Менделеева.
Атрибуты игры. Карточки с символами химических элементов.
| Fe | Cr | Cl |
| Mg | C | Cs |
| He | N | Ca |
| Li | N | Cu |
| Ag | Br | Zn |
Главный признак: металл-неметалл
| Li | N | Se |
| K | P | S |
| Ca | C | J |
| Na | Bi | O |
Главный признак- принадлежность к определенной подгруппе элементов
«лишние» -кальций, углерод, иод
| Li | Be | B | C | P | O | F | He |
| K | Mg | Al | Si | N | S | Cl | Ar |
Главный признак- принадлежность элементов к определенному периоду.
«Лишние»- фосфор, гелий
Калий, азот
Тема «Индикаторы»
Цель игры. Определить действия индикатора в разных средах.
Атрибуты игры. Карточка с заданием и формулы веществ.
Описание игры. Впишите формулы следующих оксидов в клетки таблицы в зависимости от их реакции с водой и изменением окраски индикатора: Al2O3, CO2, K2O, SO2, CaO, Fe 2O 3
| Изменения окраски индикатора | Реакция с водой | ||
| Образуется кислота | Образуется щелочь | Не осуществляется | |
| Раствор фенолфталеина окрашивается в малиновый цвет | |||
| Индикаторы не изменяют своей окраски | |||
| Раствор лакмуса окрашивается в красный цвет |
«Попади в цель»
Цель игры. Развить логическое мышление, умение систематизировать знания о свойствах химических элементов.
Атрибуты игры. Карточки
Определение формул веществ и расстановка коэффициентов
В трех связанных кружках представлены неполные записи уравнений химических реакций, выпишите формулы соответствующих веществ с необходимыми индексами и коэффициентами. 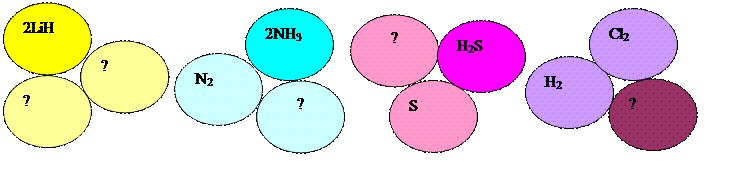
«Кислотные оксиды и соответствующие им кислоты»
Цель игры. Развить умение составлять формулы кислот по известным оксидам и наоборот
Атрибуты игры. Карточка
Описание игры. Заполните графы карточки по оксидам и соответствующим кислотам.
| Формула оксида | Название оксида | Формула кислоты, соответствующая оксиду | Название кислоты соответствующей оксиду |
| Оксид серы(IV) | |||
| SO3 | |||
| H2CO3 | |||
| Фосфорная кислота |
«Формулы кислот»
Цель игры отработать умения составлять формулы кислот.
Атрибуты игры. Карточки
Описание игры. Составьте формулы кислот на основании предложенных вам карточек.
|
|
|
|
|
|
|
|
Составьте формулы десяти кислот, комбинируя нижеприведенные составные части кислот по горизонтали (слева направо) и вертикали (сверху вниз) при условии, что кислотообразующие составные части стоят рядом.
| H | ||||||||
| H2 | Cl | H | ||||||
| H | SO4 | H2 | NO3 | H | ||||
| H2 | CO3 | H2 | S | H3 | PO4 | H2 | ||
| H | Br | H | SO3 | H | J | H4 | SiO4 | H |
«Сильные и слабые кислоты»
Цель игры. Закрепить понятие о сильных и слабых кислотах.
Атрибуты игры. Карточка с заданием.
Описание игры. Образуйте из следующих кислот ряд, который будет начинаться самой сильной кислотой и заканчиваться самой слабой кислотой. Если ряд определен правильно, вы получите начало электрохимического ряда напряжения металлов.
Фосфорная кислота (Na)
Уксусная кислота (Mg)
Азотная кислота(K)
Соляная кислота(Ca)
Угольная кислота(Al)
«Соли»
Цель игры. Отработка умений составлять формулы солей.
Атрибуты игры. Карточка.
Описание игры. Составьте формулы десяти разных солей, комбинирую нижеприведенные составные части солей по горизонтали (слева направо) и вертикали (сверху вниз) при условии, что составные части стоят рядом.
| Cu | ||||||||
| Na2 | S | O4 | ||||||
| Ca | S | O4 | S | Ca | ||||
| Ba | Cl | O4 | Cu | Na2 | S | Cu | ||
| Cu | S | O4 | Na | H | S | O4 | S | S |
«Типы химических реакций»
Цель игры. Совершенствовать знания о типах химических реакций.
Атрибуты игры. Карточки с заданиями.
Описание игры. Определите вещества А и В, напишите уравнения реакций, укажите типы реакций.
Mg+A=2MgO
S+A=SO2
MgO+B=Mg(OH)2
SO2+B=H2SO3
Mg(OH)2+ H2SO3=MgSO3+2B
«Основания»
Цель игры. Совершенствование знаний о свойствах оснований. Работа с таблицей растворимости
Атрибуты игры.Карточка
Описание игры. Поставьте крестики в клетки таблицы в зависимости от того, какими свойствами обладает данное основание.
| Основание | Растворяется в воде | Не растворяется в воде | Раствор фенолфталеина-малиновый | Раствор лакмуса- синий |
| Zn(OH)2 | ||||
| Ca(OH)2 | ||||
| NaOH | ||||
| Cu(OH)2 |
«Химические свойства оснований»
Цель игры систематизировать знания о химических свойствах оснований.
Атрибуты игры. Карточка с заданием.
Описание игры. Впишите формулы следующих оснований в клетки таблицы в зависимости от свойств оснований: Cu(OH)2, NaOH, Fe(OH)3, Ba(OH)2. Сумма номеров правильных ответов равно относительной атомной массе легкого металла. Примечание: если в одной клетке окажется несколько формул, то цифры в клетках следует умножить на число формул.
| Свойства оснований | щелочь | Нерастворимое в воде основание |
| Взаимодействует с растворами солей | ||
| Раствор фенолфталеина окрашивается в малиновый цвет | ||
| Взаимодействует с кислотами |
Описание работы. Выберите для каждого основания характерные свойства из приведенных в таблице. Буквы, соответствующие правильному ответу, дают название химического элемента, без которого не возможна жизнь на Земле.
| Свойства оснований | основания | |||
| NaOH | Fe(OH)3 | Ca(OH)2 | Cu(OH)2 | |
| Взаимодействие с кислотами | к | и | с | л |
| Разъедающее действие | о | м | р | а |
| Фенолфталеиновый окрашивается в малиновый цвет | о | м | д | с |
«Классы неорганических соединений»
Цель игры. Систематизация знаний о химическом составе веществ и определение их в разные группы. Составление формул по названию веществ
Атрибуты игры. Карточка с заданием.
Описание игры: Впишите в клетки таблицы формулы следующих соединений. Распределите их по классам неорганических соединений согласно химического состава.
Сульфат натрия, угольная кислота, оксид углерода(IV), хлорид меди(II), хлорид меди(I), оксид серы(IV), гидроксид алюминия, фосфорная кислота, гидроксид кальция.
| Химический состав соединения | Классы неорганических соединений | |||
| оксиды | основания | кислоты | соли | |
| Состоит из атомов металлов и кислотных остатков | ||||
| Состоит из атомов металлов и гидроксильных групп | ||||
| Состоит из двух элементов, один из которых кислород со степенью окисления-2 | ||||
| Состоит из атомов водорода и кислотных остатков |
Особое место среди активных форм обучения занимают сюжетно-ролевые игры, которые в учебном процессе позволяют моделировать различные жизненные ситуации и отношения.
Во-первых, они оригинальны по форме и тем самым включают один из основных внутренних мотивов учащихся к изучению предмета – интерес. А также они дают возможность рассматривать изучаемые вещества или явления с различных позиций, т.е. показывают учащимся окружающий мир таким, каков он есть на самом деле, со всеми его противоречиями.
Для проведения сюжетно-ролевой игры применяется следующая схема:
Сформировать задачу.
Поставить цель пред собой, которая должна быть достигнута по завершению обсуждения игры.
Выбрать благоприятный момент для использования игры и распределения ролей.
Поставить цель перед классом и дать четкую инструкцию.
Проверить правильность понимания цели.
Распределить роли, приводя в случае необходимости примеры её исполнения.
Установить регламент.
Организовать место проведения игры.
Не затягивать игру.
Для проведения урока “Суд над хлором” были созданы группы учащихся по направлениям: химики, биологи, экологи, литераторы, играющие определенную роль на уроке, которые занимались отбором материала для урока. Урок сопровождался применением компьютерных технологий (представитель химической лаборатории демонстрировал химические опыты, подтверждающие свойства соляной кислоты и свойства хлора).
Сюжетно-ролевая игра “Суд над хлором”
Цель. Дать представление о составе и строении хлора, его физических и химических свойствах, положительной и отрицательной роли этого газа, соединениях хлора, их значении.
Оборудование и реактивы. Zn, CuO, Cu(OH)2, AgNO3, HCl, яичная скорлупа, индикаторы.
Участники судебного заседания: секретарь суда, судья, прокурор, подсудимый хлор, адвокат, защитник, представитель химической лаборатории, эксперты – эколог, биолог, химик, химик-технолог, судмедэксперт, два свидетеля, два журналиста.
Ход урока
Секретарь суда. Встать! Суд идет! Прошу всех сесть. Прошу доложить явку ответчиков, истцов, пострадавших, свидетелей, экспертов.
Секретарь суда. Присутствуют все. Начинаем судебное заседание. Слово судье (называет настоящие фамилию, имя, отчество ученика, играющего роль судьи).
Судья. Сегодня в этом зале вершится суд над хлором – газом зеленовато-желтого цвета, с очень резким запахом. Вдыхание его даже в небольших количествах вызывает сильное раздражение дыхательных путей и воспаление слизистых оболочек. Более значительное количество хлора может вызвать тяжелое отравление и даже смерть. Хлор растворяется в воде, обладает следующими химическими свойствами:
взаимодействует
с металлами: 2Na + Cl2 =2NaCl
с водородом: H2 + Cl2 = 2HCl
с водой: H2O + Cl2 = HClО + HCl
с щелочью: 2NaOH + Cl2 = NaCl + NaClO + H2O.
Хлор обвиняется в нанесении вреда всем живым существам – от едва различимых под микроскопом бактерий до крупных животных и человека. Вступая в реакции почти со всеми химическими элементами, в том числе со многими металлами, убивает их, не дает возможности существовать в свободном виде, наносит вред окружающей среде. Суду необходимо:
определить состав преступления, выслушав прокурора;
подтвердить преступную деятельность показаниями свидетелей;
выслушать показания обвиняемого – хлора;
познакомиться с показаниями защитников обвиняемого;
принять справедливое решение.
Слово по составу преступления предоставляется прокурору.
Прокурор. Гражданин хлор и его производные действительно загрязняют окружающую атмосферу и делают ее неблагоприятной для жизни человека и животных. Гражданин хлор виновен в массовом убийстве людей на войне и в мирное время. Хлор агрессивен, нападает на вещества, и они перестают существовать в свободном виде. Все это означает, что нужно судить гражданина хлора по всей строгости закона и изолировать его от общества.
Судья. Суд выслушал обвинение, выдвинутое в адрес гражданина хлора, и приступает к слушанию свидетельских показаний. Приглашается 1-й свидетель.
1-й свидетель. В первую мировую войну хлор нашел неожиданное применение как оружие массового уничтожения. Послушаем отрывок из романа М.Шолохова «Тихий Дон», где описывается зелено-желтый газ, который стал убийцей многих тысяч людей: “На рассвете 3 октября немцы, употребив удушливые газы, отравили три батальона 256-го полка и заняли первую линию… Валет, клацнув зубами, отпрыгнул, и на то место. Где секунду назад стояли его ноги, спиленным деревом упал стоявший под сосной человек. Они перевернули его лицом вверх и тут только догадались, что под сосной нашел себе последний приют этот отравленный газами, бежавший от смерти, которую нес в своих легких, солдат одного из трех батальонов 256-го пехотного полка. Рослый, широкоплечий парень, он лежал вольно откинув голову с лицом, измазанным при падении клейкой грязью, изъеденным газом, разжиженными глазами, из стиснутых зубов его черным глянцевидным бруском торчал пухлый мясистый язык.
- Пойдем. Пойдем ради бога! Пусть он себе лежит, - шепнул товарищ, дергая Валета за руку.
Они пошли и сейчас же наткнулись на второй труп. Мертвые стали попадаться чаще. В нескольких местах отравленные лежали копешками, иные застыли сидя на корточках, некоторые стояли на четвереньках – будто паслись, а один, у самого хода сообщения, ведущего во вторую линию окопов, лежал, скрючившись калачиком, засунув в рот искусанную от муки руку”.
Судья. Слово по этому факту предоставляется судмедэксперту.
Судмедэксперт. Действительно, хлор очень токсичен. Он раздражает слизистые оболочки глаз и дыхательных путей. Острое отравление развивается почти немедленно. При вдыхании хлора отмечаются стеснение и боль в груди, сухой кашель, учащенное сердцебиение, резь в глазах, слезотечение, повышение лейкоцитов в крови и температуры тела. Возможны бронхопневмония, токсический отек легких, депрессивное состояние, судороги. В легких случаях отравления выздоровление наступает через 3-7 суток.
Судья. Спасибо. Слово предоставляется следующему свидетелю.
2-й свидетель. Вскоре после хлора был применен другой удушающий газ – фосген. Это соединение хлора с оксидом углерода:
CO + Cl2 = COCl2
В 1917 г. массовое применение нашел иприт, который тоже содержал в себе хлор. К концу войны применялось более 50 различных боевых отравляющих веществ (ОВ), 95% которых – производные хлора. Чтобы судить об эффективности ОВ на полях войны, достаточно указать, что в одной только английской армии, занимавшей среди воюющих государств пятое место по своей численности, с июля 1917 г по ноябрь 1918 г ОВ вывели из строя более 160 тыс. человек.
Судья. Спасибо. Теперь все понятно. Но хлор имеет сообщников. Он нашел их в среде неметаллов. Например, водород на свету активно взаимодействует с хлором, да еще со взрывом.
2-й свидетель. Уважаемые судьи! Я и сам не понимаю, как у такого почтенного родителя, как водород, мог родиться этот бесцветный газ с резким запахом. При вдыхании раздражает дыхательные пути и вызывает удушье. Он в 1,3 раза тяжелее воздуха; очень быстро растворяется в воде, в одном объеме воды растворяется 500 объемов хлороводорода. Называется соляной, или хлороводородной кислотой.
Судья. Спасибо. Для дачи показаний приглашается представитель химической лаборатории.
Представитель химической лаборатории. Соляная кислота – бесцветная жидкость. Концентрированная кислота содержит до 37% хлороводорода и на воздухе “дымит”. Будучи сильной кислотой, она обладает всеми их свойствами. Многие металлы, основные оксиды, основания, некоторые соли и газы взаимодействуют с соляной кислотой:
Zn + 2HCl = ZnCl2 + H2,
CuO + 2HCl = CuCl2 + H2O,
Cu(OH)2 + 2HCl = CuCl2 + 2H2O,
AgNO3 + HCl = AgCl + HNO3,
NH3 + HCl = NH4Cl.
А нитрат серебра от соляной кислоты без ума; при появлении у него мутнеет рассудок.
Судья. Спасибо. Приглашается для дачи показаний эколог. Что вы можете сказать об участии хлороводорода и соляной кислоты в образовании кислотных дождей?
Эколог. Впервые кислотные дожди были отмечены в Скандинавии. Потом появились на северо-востоке США. Сейчас проблема, связанная с кислотными дождями существует во всем индустриальном мире. Рыба исчезла из многих озер. Поверхность каменных и бетонных домов, мраморных статуй разъедена. Сельскохозяйственные культуры замедлили темп роста, леса умирают. Новая Зеландия и Скандинавия – регионы, наиболее пострадавшие от кислотных дождей, но последние в настоящее время распространились по всему миру.
Судья. По вопросу кислотных дождей прошу пригласить эксперта-химика.
Химик. Я могу показать, как кислотные дожди влияют на скорлупу яиц.
(Демонстрация опыта:CaCO3 + 2HCl = CaCl2 + H2O + CO2 .)
Вы видите, что скорлупа растворяется. Аналогично кислотные дожди действуют на мраморные статуи.
Судья. Итак, суд заслушал показания свидетелей и экспертов. Переходим к судебным прениям. Слово предоставляется защите.
Адвокат. Уважаемый суд! Из показаний свидетелей и экспертов ясно, что у хлора наряду с недостатками существуют и достоинства.
Впервые хлор был использован в медицине. Раствор хлора в воде – хлорная известь – рекомендовался как дезинфицирующее средство врачам и студентам-медикам при работе в моргах.
С помощью соединений, содержащих хлор, отбеливают хлопчатобумажные, льняные ткани и целлюлозу соответственно в текстильной и бумажной отраслях промышленности. Ведь до появления этих соединений в некоторых европейских, особенно северных, странах весенней порой поля и луга устилали льняными тканями, которые под воздействием солнечных лучей и других природных факторов приобретали необходимую белизну. Для лугового отбеливания ткани из Англии отправляли даже в Голландию, а купцы из французского города Бордо вывозили на африканское побережье.
За последние десятилетия широкое распространение получило хлорирование воды – обеззараживание. Введение в водопроводную воду газообразного хлора в количествах, безопасных для человеческого организма, приводит к уничтожению в воде болезнетворных микробов, устранению неприятных привкусов и запахов.
В цветной металлургии хлорированием руд извлекают из них некоторые металлы (титан, ниобий, тантал). В химии высокомолекулярных соединений хлор используют для получения пластмасс, синтетических волокон, каучука, соляной кислоты и т.д.
Хлор действительно токсичен, за ним глаз да глаз нужен. Единственное, что он требует от всех, - это соблюдение правил техники безопасности.
Защита просит пригласить для дачи показаний биолога.
Судья. Слово биологу.
Биолог. Хлор – один из биогенных элементов, постоянный компонент тканей растений и животных. Суточная потребность взрослого человека в хлоре составляет 2-4 г. и покрывается за счет пищевых продуктов.
С пищей хлор поступает в организм в виде хлорида натрия и хлорида калия. Особенно богаты хлором хлеб, мясные и молочные продукты. В организме хлор играет большую роль в вводно-солевом обмене, способствуя удержанию тканями воды.
Судья. Спасибо. Слово предоставляется защите.
Защитник. Я хочу сказать, что активность хлора “убила” его самого. В природном состоянии он не встречается. Если в редких случаях и происходит его выделение (например, при извержениях подводных морских вулканов), то в очень небольших количествах, и хлор тотчас же исчезает, взаимодействуя с окружающими веществами.
Хлор входит в состав поваренной соли – вещества, необходимого для организмов животных и человека. В организме человека содержится около 200 г соли. Важное значение соли в организмах наземных животных и близкие значения соотношений между солью и другими соединениями хлора, находящимися в крови наземных животных и морской воде, дают повод ученым говорить о происхождении наземных животных из морских организмов.
Прошу дать слово эксперту-биологу.
Судья. Разрешаю.
Биолог. Соль участвует в важнейших физиологических процессах человека и животных. Она содержится в слюне, желудочном соке, желчи и лимфе. Наличие хлорида натрия в крови обеспечивает необходимое осмотическое давление, от которого зависит нормальная жизнедеятельность клеток.
Почти все нужные нашему организму минеральные соли содержатся в обычной пище. Только хлорида натрия в ней хватает. Для поддержания жизни человек должен получать 20-25 г соли ежедневно.
Каждый человек потребляет в год 6-8 кг соли.
Защитник. Для защиты прошу предоставить слово эксперту химику-технологу.
Судья. Разрешаю.
Химик-технолог. Ныне мировая добыча поваренной соли составляет 100 млн. т в год. На пищевые нужды расходятся лишь около четвёртой её части. Куда же идёт остальная часть? Поваренная соль необходима при производстве мясных и рыбных консервов, в металлургической отрасли промышленности, при обработке мехов, сыромятных кож, при варке мыла, в медицине. Но главный потребитель поваренной соли – химическая отрасль промышленности. И трудно сказать, каким новым отраслям народного хозяйства она еще понадобится. Но и сейчас в движении атомных подводных лодок, в полетах космических кораблей, в создании огромного количества окружающих нас материалов участвует хлорид натрия – “соль земли”.
Судья. А теперь последнее слово предоставляется подсудимому.
Подсудимый. Уважаемый суд! Я обращаюсь к вам со своим последним словом. Учтите, пожалуйста, что в свободном виде в природе я встречаюсь только в экспериментальных ситуациях. Человек сам получает хлор и по своему усмотрению им распоряжается, нарушая технологию и используя его против человечества. Я себя виноватым не считаю.
Судья. Итак, мы заслушали свидетелей, экспертов, защитников и подсудимого. Прокурор, предоставляю вам слово.
Прокурор. Учитывая в совокупности все показания свидетелей, экспертов и защитников, я отказываюсь от поддержания обвинения в суде.
Судья. Суд удаляется для выяснения приговора.
Секретарь суда. Внимание! В зале судебных заседаний работают журналисты радио и телевидения. Они хотят побеседовать с вами – участниками данного судебного заседания.
Журналисты начинают работу, направленную на закрепление сведений, полученных на уроке, задают вопросы и слушают ответы.
Журналисты.
Какое впечатление произвел на вас подсудимый?
Какие черты личности вам особенно запомнились?
Кто за то, чтобы его осудили? Поднимите, пожалуйста, руки.
Почему вы за осуждение хлора?
Назовите, пожалуйста, факты, свидетельствующие в пользу освобождения хлора.
Как вы в целом оцениваете все происходящее в этом зале? (Вопрос гостям, присутствующим на уроке.)
У кого есть чувство жалости и сострадания к подсудимому? Почему вы ему сочувствуете?
Как вы оцениваете участие других действующих лиц этого судебного процесса – судьи, прокурора, свидетелей, защитников? Как они справились со своими ролями?
Хотите ли вы сами участвовать в подобном действии в дальнейшем?
Секретарь суда. Встать! Суд идет…
Судья. Прошу всех сесть. Заслушав и обсудив показания свидетелей, обвиняемого, экспертов, защитников, суд сделал следующие выводы:
Благодаря хлору существует огромное многообразие химических веществ, имеющих большое практическое значение.
Хлор, обеззараживая воду, спасает людей от инфекции и сохраняет им здоровье.
Суд считает необходимым оправдать хлор, т.к. в природе в свободном состоянии он не встречается.
Суд осуждает человека за то, что он производит вещества, убивающие людей, нарушает технологии, не заботится в полной мере об окружающей среде.
Секретарь суда. Внимание! Журналисты сообщили, что готов вариант радиопередачи, и предлагают ее прослушать.
Включают магнитофоны (звучат позывные какой-либо передачи).
“Внимание, в честь Дня химика в средней школе № 2 г. Слуцка состоялось заседание суда. Прошел судебный процесс над гражданином хлором”.
Судья. Суд принял решение: даровать подсудимому свободу! Теперь слово предоставляется учителю для подведения результатов.
Урок завершается применением рефлексии по принципу незаконченного предложения:
Сегодня я на уроке закрепил и углубил знания по …
Сегодня я на уроке узнал …
После сегодняшнего урока я буду относиться к окружающим …
Кроссворд по теме «Вода»
| д | о | ж | д | ь | |||||||||||
| б | |||||||||||||||
| р | л | ||||||||||||||
| с | о | с | у | л | ь | к | а | ||||||||
| с | е | к | |||||||||||||
| т | у | ч | а | д | а | ||||||||||
| у |
Понравилась статья? Добавь ее в закладку (CTRL+D) и не забудь поделиться с друзьями:
 Сейчас читают про:
|
 2015-07-21
2015-07-21 2281
2281







