Современные процессы основного неорганического синтеза, нефтепереработки, нефтехимии и органического синтеза невозможно представить без применения катализаторов. Около 90 % промышленных химико-технологических процессов ведут с применением катализаторов в качестве активаторов. Примерами неорганического синтеза являются технологические процессы производства аммиака, азотной и серной кислот; нефтехимии и органического синтеза – процессы производства метанола, стирола, бутадиена, фенола и ацетона, ацетальдегида и других продуктов. В нефтепереработке – это процессы каталитического крекинга и риформинга, гидроочистки и гидрокрекинга, алкилирования изобутана и изомеризации парафиновых углеводородов, производства оксигенатов.
Каталитические процессы имеют ряд важных преимуществ по сравнению с некаталитическими процессами. Кроме того, что применение катализаторов резко ускоряет скорости химических реакций, процессы с их использованием могут быть организованы как непрерывные, безотходные и менее энергоемкие, отличающиеся высокими технико-экономическими показателями и обеспечивающие более высокий выход целевых продуктов.
|
|
|
Применение катализаторов позволяет интенсифицировать химико-технологические процессы, а в ряде случаев осуществлять процессы, которые на практике без катализаторов не могут быть реализованы. Особо значимо использование катализаторов при обратимых экзотермических процессах, что позволяет существенно снижать температуру процесса и добиваться приемлемой степени превращения сырья.
Определение понятию катализа можно сформулировать следующим образом.
Катализ – это явление, состоящее в том, что присутствие в системе какого-либо вещества вызывает или ускоряет (реже замедляет) протекание некоторой химической реакции, либо открывает новый путь для химического процесса. Само это вещество в конце реакции оказывается неизменным (в химическом смысле, так как физическое состояние катализатора может достаточно сильно отличаться от исходного). С точки зрения формальной химической кинетики это означает, что у всех каталитических реакций имеется циклический каталитический маршрут. Отметим, что катализатор не сдвигает химическое равновесие, а только изменяет скорость протекания химического процесса. Это означает, что катализатор одинаково влияет на протекание и прямой и обратной реакций. Каждый катализатор способен катализировать только вполне определенные реакции или классы реакций.
Специфичность действия катализатора может различаться весьма сильно: от уникальности в случае некоторых ферментов до катализа многих классов реакций. Общий принцип действия катализатора состоит в снижении энергии активации. Схематическая зависимость энергии реагирующей системы от координаты реакции приведена на рисунке 6.1 (для реакции без катализатора – сплошная линия и реакции с участием катализатора – пунктирная).
|
|
|
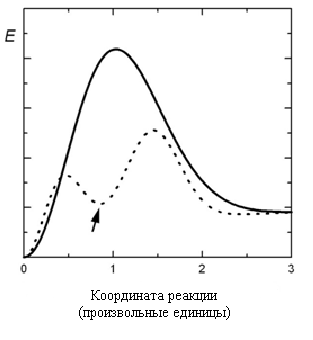
Рис. 6.1. Зависимость энергии реагирующей системы
от координаты реакции
Из рисунка 6.1 видна главная особенность действия катализатора – образование промежуточного продукта (комплекса «субстрат – катализатор», показано стрелкой), что приводит к разбиению исходной элементарной реакции, по крайней мере, на две стадии, каждая из которых имеет энергию активации, меньшую энергии активации исходной реакции.
В зависимости от места протекания реакции катализ подразделяется на гомогенный и гетерогенный. Если реагенты и катализатор находятся в одной жидкой или газовой фазе, то это гомогенный катализ, если в разных фазах (газ – твердое тело или жидкость – твердое тело), то это гетерогенный катализ.
Существует и гомогенно-гетерогенный катализ, когда начавшаяся на гетерогенном катализаторе реакция продолжается затем в объеме другой фазы.
Гетерогенный катализ наиболее распространен в химической технологии. Он отличается рядом достоинств, например, простотой разделения катализатора и продуктов процесса, высокой термостойкостью и сравнительной легкостью регенерации собственно катализатора.
Каталитические гетерогенные реакции сопровождаются рядом явлений, связанных со свойствами твердых тел, неоднородных по химическому и фазовому составу. Важнейшую роль играют нарушения структуры (дефекты) кристаллической решетки катализаторов. Эти нарушения обусловливают энергетическую неоднородность поверхностных атомов и обеспечивают определенную сорбционную способность поверхности катализатора. В целом эффективность применения катализаторов определяется комплексом их химических и физических свойств.
 2015-08-21
2015-08-21 977
977








