Ферменты – это вещества белковой природы, которые служат катализаторами биохимических процессов.
Особенности действия ферментов по сравнению с обычными катализаторами:
1) проявляют активность в мягких условиях;
2) действуют специфично, т. е. изменяют скорость только определенной реакции или группы реакций;
3) ускорение биохимических процессов под действием ферментов чрезвычайно велико (до 1010 раз);
4) действуют в узком интервале температур и рН среды.
Ферментативная реакция - это сложная реакция, механизм которой может быть представлен следующей схемой:
1) E + S ES
2) ES P + E,
где S – субстрат - вещество, на которое фермент оказывает каталитическое
действие;
Е – фермент (энзим);
ES – фермент-субстратный комплекс;
Р – продукт;
k1, k –1 и k2 – константы скоростей соответствующих реакций.
Обозначим через [E], [S] и [ES] текущие концентрации фермента, субстрата и фермент-субстратного комплекса, а через [E]0 и [S]0 – начальные концентрации фермента и субстрата.
Запишем в соответствии с законом действия масс кинетические уравнения для элементарных стадий ферментативной реакции.
|
|
|
Скорость образования фермент-субстратного комплекса V1 равна
V1 = k1[E][S],
Концентрация субстрата, как правило, гораздо больше, чем концентрация фермента:
[S]>>[E].
Поэтому можно считать, что концентрация субстрата в ходе ферментативной реакции практически не меняется и равна начальной концентрации:
[S] = [S]0 = const.
Текущая концентрация фермента равна:
[E] = [E]0 – [ES].
Таким образом, скорость образования фермент-субстратного комплекса определяется уравнением:
V1 = k1([E]0 – [ES]) [S]0.
Скорость распада фермент-субстратного комплекса на фермент и субстрат V-1 равна:
V-1 = k-1[ES].
Скорость распада фермент-субстратного комплекса на фермент и продукт V2 определяется уравнением:
V2 = k2[ES]. (1)
Стадия распада фермент-субстратного комплекса на продукт и фермент является лимитирующей и определяет скорость процесса в целом.
Уравнение (1) не может быть использовано для описания кинетики ферментативной реакции, так как величину [ES] нельзя измерить. Необходимо выразить [ES] через начальные концентрации фермента и субстрата. Для этого допускают, что процесс протекает при стационарном состоянии. Это означает, что [ES] = const, поскольку скорость его образование равна скорости его распада:
V1 = V-1 + V2
Тогда k1([E]0 – [ES]) [S]0 = k-1[ES] + k2[ES].
Решим полученное уравнение относительно [ES]:
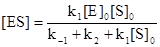 .
.
Разделив числитель и знаменатель на k1 и введя обозначение 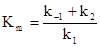 , получим:
, получим:
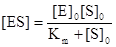 , где Km – константа Михаэлиса.
, где Km – константа Михаэлиса.
Подстановка полученного выражения для концентрации фермент-субстратного комплекса в уравнение (1), дает основное уравнение кинетики ферментативных реакций - уравнение Михаэлиса-Ментен:
|
|
|
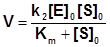 .
.
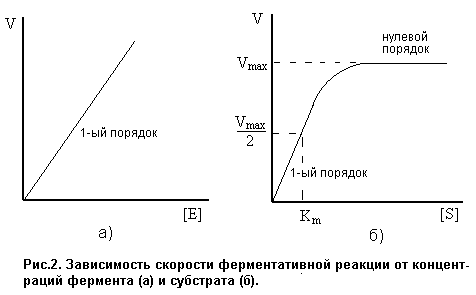
Вид кинетического уравнения показывает, что ферментативная реакция имеет 1-ый порядок по ферменту (рис.2а). Порядок реакции по субстрату зависит от его концентрации.
Если концентрация субстрата мала, то Km>>[S]0, и уравнение Михаэлиса-Ментен принимает вид:
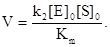
Т. е., при малых концентрациях S реакция имеет 1-ый порядок по субстрату (рис.12.8)
 |
Если концентрация субстрата велика, то Km<< [S]0, и уравнение Михаэлиса-Ментен принимает вид:
V = k2 [E]0.
Т. е., при высоких концентрациях S реакция имеет нулевой порядок по субстрату. Это означает, что при высокой концентрации субстрата все молекулы фермента связаны в фермент-субстратный комплекс, и дальнейшее увеличение концентрации субстрата не влияет на скорость реакции. Скорость ферментативной реакции принимает максимально возможное в данных условиях значение:
Vmax= k2 [E]0.
Подставив значение Vmax в уравнение Михаэлиса-Ментен, получим:
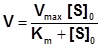 .
.
Km, k2 и Vmax – основные характеристики ферментативной реакции. Рассмотрим физический смысл величин Km и k2.
Решив уравнение Михаэлиса-Ментен относительно Km, получим: 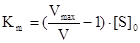 .
.
Если V=1/2Vmax, то Km=[S]0. Таким образом, константа Михаэлиса численно равна концентрации субстрата, при которой скорость ферментативной реакции достигает половины максимального значения. Константа Михаэлиса измеряется в моль/л и принимает значения: 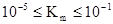 .
.
Из уравнения для максимальной скорости ферментативной реакции следует, что
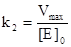 .
.
Величину k2 называют молекулярной активностью или числом оборотов фермента. Она численно равна числу молекул субстрата, которое превращается под действием одной молекулы фермента в единицу времени. Константа k2 измеряется в мин-1 и принимает значения: 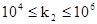 .
.
 2015-08-21
2015-08-21 1095
1095








