1. Определите, к какому электроду должны перемещаться частицы золя, получаемого при реакции при небольшом избытке H2S:
2H3AsO3+3H2S=As2S3+6H2O
Решение. Потенциал определяющими ионами в данном случая могут быть ионы SH-, так как в состав агрегата входят ионы серы. Состав адсорбционного слоя могут входить ионы Н+. Ионы Н+ образуют диффузный слой. Таким образом, схематическое строение мицеллы золя можно выразить следующей формулой:
{[(As2S3)m·n SH-]· Н+}(n-x) Н+
Частица имеет отрицательный заряд, - следовательно, электрофоретическое движение направлено к аноду.
2. Время половинной коагуляции золя иодида серебра при исходном содержании частиц в 1 м3, равном 3,2·1014, составляет 11,5 с. Определите константу скорости коагуляции.
Решение. Расчет проводим, используя формулу, связывающую константу скорости коагуляции с временем половинной коагуляции:
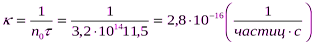
3. Золь иодида серебра, получаемый по реакции:
KI+AgNO3→AgI+KNO3
при некотором избытке KI, коагулируют растворами сульфата калия и ацетата кальция. Коагулирующее действие какого электролита сильнее?
Решение. Строение мицеллы золя таково:
{[(AgI)m·nI-]xK+}(n-x)K+
Ионами, образующими диффузный слой, т.е. противоионами, являются катионы K+. Следовательно, при сравнении коагулирующего действия необходимо сравнивать заряды катионов вводимого электролита. Так как заряд иона Са2+ выше заряда иона K+, то в соответствии с правилом Шульце-Гарди коагулирующее действие Са(СН3СОО)2 сильнее.
Задачи
1. Золь AgI получен при добавлении 8 мл водного раствора КI концентрацией 0,05 моль/л к 10 мл водного раствора AgNO3концентрацией 0,02 моль/л. Напишите формулу мицеллы образовавшегося, золя. Как заряжена частица золя?
2. Золь гидроксида железа (III) получен при добавлении к 85 мл кипящей дистиллированной воды 15 мл 2%-ного раствора хлорида железа(III). Напишите формулу мицелл золя Fе(ОН)3, учитывая, что при образовании частиц гидроксида железа(Ш) в растворе присутствуют следующие ионы Fе+3, СI-. Как заряжены частицы золя?
3. Во сколько раз уменьшится суммарное число частиц νΣ мартеновских печей через 1, 10, 100 с после начала коагуляции? Средний радиус частиц 20 нм, концентрация 1·10 -3 кг/м3, плотность частиц 2,2 г/см3. Константа быстрой коагуляции, по Смолуховскому, равна 3·10 -16 м3/с.
4. При исследовании коагуляции полистирольного латекса получены следующие значения порогов коагуляции:
| Электролит | NaCI | CaCI2 | AICI3 |
| Порог коагуляции, моль/л | 0,47 | 8,8·10-3 | 6·10-4 |
Рассчитайте соотношение порогов коагуляции и сопоставьте его с соотношением, получаемым в соответствии с правилом Дерягина - Ландау.
5. Порог коагуляции отрицательно заряженного гидрозоля As2S3 под действием КСI равен 4,9·10 -2 моль/л. С помощью правил Шульце - Гарди и Дерягина - Ландау для этого золя рассчитайте пороги коагуляции, вызываемой следующими электролитами: К2S04, MgCI2, MgSO4, А1С13 и А12(S04)3.
6. Порог коагуляции положительно заряженного гидрозоля Fе(ОН)з под действием электролита NaCI равен 9,25 ммоль/л. С помощью правил Шульце - Гарди и Дерягина - Ландау для этого золя рассчитайте пороги коагуляции, вызываемой следующими электролитами: KNO3, BaCI2, K2S0 4, MgS04, К 2Cr2O7.
7. Порог коагуляции гидрозоля металлического золота, вызываемой NaCI, равен 24 ммоль/л, a K2S04 - 11,5 ммоль/л. Используя правила Шульце - Гарди и Дерягина - Ландау, определите знак заряда золя и рассчитайте порог коагуляции для, следующих электролитов; СаСI2, MgS04, АI2(S04)3, АIСI3, Th(NO3)4.
8. Напишите схему строения мицелл сульфида цинка, образующихся при получении золя: а) в случае избытка ZnSO4; б) в случае избытка (NH4)2SO4, по следующей реакции:
ZnSO4+(NH4)2S=ZnS+(NH4)2SO4.
9. Напишите схему строения мицеллы сульфата бария, получающегося при взаимодействии хлорида бария с некоторым избытком сульфата натрия.
10. Укажите, к какому электроду должны двигаться частицы гидроксида алюминия, образующиеся при гидролизе. Принять, что гидролиз протекает неполно:
AICI3+H2O=AI(OH)3+3HCI.
11. В воде содержатся ультрамикроскопические радиоактивные частицы. Для очистки воды от них предложено вводить электролиты: хлорид алюминия или фосфат калия. Предварительно установлено, что частицы при электрофорезе движутся к катоду. Какой электролит следует предпочесть в данном случае?
12. Золь гидроокиси железа, получаемый неполным гидролизом хлорного железа, коагулируют растворами сульфида натрия, хлорида натрия и хлорида бария. Какой из электролитов окажет наиболее значительное коагулирующее действие?
13. Изучение быстрой коагуляции суспензии каолина, проводимое путем счета частиц с помощью ультрамикроскопа, дало следующие результаты:
| Время коагуляции, с | 0 | 105 | 180 | 255 | 335 | 420 |
| Общее кол-во частиц в 1 м3золя, 10-14 | 5,0 | 3,90 | 3,18 | 2,92 | 2,52 | 2,00 |
Рассчитайте по приведенным данным время половинной коагуляции.
14-27. Написать строение мицеллы золя, полученного по реакции. Определить к какому электроду будет двигаться коллоидная частица:
14. AI(OH)3, стабилизированный AICI3.
15. SiO2, стабилизированный H2SiO3.
16. Au, стабилизированный КAuO2.
17. As2S3, стабилизированный H2S.
18. Ba(OH)2,стабилизированный BaCI2.
19. PbS, стабилизированный Pb(NO3)2.
20. FeS, стабилизированный Fe2(SO4)3.
21. CrO3, стабилизированный H3CrO6.
22. Ni(OH)2, стабилизированный Ni(NO3)2.
23. Pt, стабилизированный H3(PtCI)6.
24. BaCI2+Na2 SO4=BaSO4+2NaCI; в избытке Na2SO4.
25. ZnSO4+(NH4)2S=ZnS+(NH4)2SO4 ; в избытке (NH4)2S.
26. Время половинной коагуляции тумана минерального масла с удельной поверхностью 1,5*107 м-1 , концентрацией 25 мг/л составляет 240 с. Рассчитайте и постройте кривую изменения суммарного числа частиц при коагуляции для следующих интервалов времени: 60, 120, 240, 480 и 600 с. Плотность масла 0,970 г/см3.
27. При изучении оптическим методом кинетики электролитной коагуляции гидрозоля AgJ, стабилизированного ПАВ, получено значение константной скорости быстрой коагуляции, равное 3,2*10-18м3/с (при 293К). Вязкость среды 1*10-3Па*с. Сравните эту константу с константой, даваемой теорией Смолуховского. Объясните влияние ПАВ на характер коагуляции.
28. По экспериментальным данным время половинной коагуляции гидрозоля составляет340 с при исходной частичной концентрации частиц 2,52*1014част/м3, вязкости дисперсионной среды 1*10-3Па*с, и температуре 293 К. Сделайте вывод, быстрой или медленной является коагуляция, если вязкость среды увеличить в 3 раза.
29. Во сколько раз уменьшится суммарное число частиц 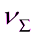 дыма мартеновских печей через 1, 10, 100 с после начала коагуляции? Средний радиус частиц 20 нм, концентрация 1*10-3 кг/м3, плотность частиц 2,2 г/см3. Константа быстрой коагуляции по Смолуховскому равна 3*10-16м3/с.
дыма мартеновских печей через 1, 10, 100 с после начала коагуляции? Средний радиус частиц 20 нм, концентрация 1*10-3 кг/м3, плотность частиц 2,2 г/см3. Константа быстрой коагуляции по Смолуховскому равна 3*10-16м3/с.
30. Рассчитайте константу быстрой коагуляции золя серы среды под действием хлорида алюминия, используя следующие экспериментальные данные:
τ, с 0 2 4 10
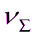 *10-17, част/м3 16,0 0,99 0,50 0,20
*10-17, част/м3 16,0 0,99 0,50 0,20
31. Рассчитайте время половинной коагуляции, используя экспериментальные данные по изменению общего числа частиц при коагуляции ……………… дисперсной системы в воде:
τ, с 0 7,0 15,0 20,2 28,0
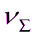 *10-15, част/м3 32,2 24,2 19,9 16,7 14,2
*10-15, част/м3 32,2 24,2 19,9 16,7 14,2
32. Проверьте применимость теории Смолуховского к коагуляции золя селена раствором хлорида калия, используя следующие экспериментальные данные:
τ, с 0 0,66 4,25 19,0 43,0
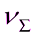 *10-14, част/м3 29,70 20,90 19,10 14,40 10,70
*10-14, част/м3 29,70 20,90 19,10 14,40 10,70
33. Рассчитайте число первичных частиц гидрозоля золота при коагуляции электролитом к моменту времени τ=150с, если первоначальное число частиц в 1м3 составляет 1,93/1014, а константа скорости быстрой коагуляции равна 0,2*1017м3/с.
34. Рассчитайте константу скорости быстрой коагуляции суспензии каолина в воде по данным кинетики коагуляции, полученным с помощью ультрамикроскопа (при 293 К)
τ, с 0 100 175 250 400 500
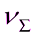 *10-14, част/м3 5,0 3,78 3,23 2,86 2,22 1,96
*10-14, част/м3 5,0 3,78 3,23 2,86 2,22 1,96
35. При изучении коагуляции суспензии ………… …………. в воде методом счета частиц в ультрамикроскопе получены следующие данные:
τ, с 335 510 600 800
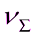 *10-14, част/м3 2,52 1,92 1,75 1,49
*10-14, част/м3 2,52 1,92 1,75 1,49
Высокомолекулярные соединения, полимеры — вещества, обладающие большим молекулярным весом (от нескольких тысяч до нескольких миллионов). К природным высокомолекулярным соединениям(биополимерам) относятся белки (см.), нуклеиновые кислоты (см.), полисахариды (см.) и т. д. К синтетическим — различные пластмассы (см.), синтетические каучуки и волокна. Высокомолекулярные соединения - продукты химического соединения (полимеризации или поликонденсации) большого количества низкомолекулярных соединений (мономеров), играющих роль отдельных звеньев в макромолекуле полимера; при этом мономеры могут быть одинаковыми (например, из этилена - полиэтилен) или различными (например, остатки разных аминокислот в белках). Макромолекулы высокомолекулярных соединений имеют линейное или разветвленное строение; при соединении их поперечными связями возникают трехмерные пространственные полимеры (вулканизованный каучук, пластмассы, дубленый коллаген и т. д.).
Биополимеры выполняют в организме важные функции — управление обменом веществ (белки), передача и хранение генетической информации (нуклеиновые кислоты), защитные и энергетические функции (полисахариды) и т. д. В ряде случаев более сложные и специфические функции выполняют смешанные полимеры, — углеводопептиды (иммуноспецифические вещества), нуклеотидпептиды и др. Биополимеры, как правило, имеют сравнительно простую основу (например, полирибозофосфатную цепь в нуклеиновых кислотах, полипептидную в белках). Функциональная информация зафиксирована в первичной структуре, т. е. зависит от последовательности нуклеиновых оснований (в нуклеиновых кислотах) или аминокислотных остатков (в белках). Первичная структура определяет вторичную и третичную, т. е. расположение частей макромолекулы в пространстве, а это в свою очередь определяет биохимические функции соединений. Чем больше субъединиц входит в состав макромолекулы, тем более тонкие и сложные функции она может выполнять. Молекулы ДНК («планирующий» центр клетки) имеют мол. вес 107—108. Белки, транспортные РНК — «исполнительные органы», имеют молекулярный вес порядка 104 и выполняют более ограниченные функции.
Так как физические свойства вещества являются функцией молекулярного веса и архитектоники молекулы, высокомолекулярные соединения резко отличаются по физико-химическим свойствам от составляющих их субъединиц. Характерная особенность биополимеров — упорядоченное расположение частей макромолекулы. Температурные воздействия, изменения рН и солевой концентрации приводят к разрушению высших структур макромолекул.
Среди синтетических высокомолекулярных соединений, применяющихся в медицине, следует отметить поливинилпирролидон (ПВП), полиметилметакрилат, «гидрофильные пластмассы». Они служат кровезаменителями, используются как материал для костных протезов и т. д. Перспективно применение силиконовых клеев для склеивания кожи. и мышц (вместо сшивания) после операции. «Гидрофильные пластмассы», способные впитывать до 60% (повесу) воды без изменения размеров и прочности, применяются для изготовления контактных линз, для замещения тканей организма и т. д.
 2015-08-13
2015-08-13 11263
11263







