|
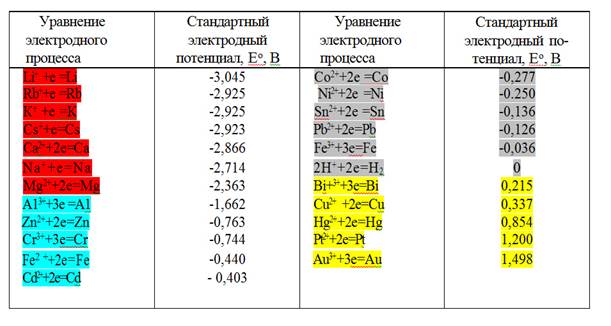
1. Чем меньшее значение имеет электродный потенциал металла, тем он химически активнее, легче окисляется и труднее восстанавливается из своих ионов. Активные металлы в природе существуют только в виде соединений Na, K,..., встречаются в природе, как в виде соединений, так и в свободном состоянии Cu, Ag, Hg; Au, Pt - только в свободном состоянии;
2. Металлы, имеющие более отрицательный электродный потенциал, чем магний, вытесняют водород из воды;
3. Металлы, стоящие в ряду напряжений до водорода, вытесняют водород из растворов разбавленных кислот (анионы которых не проявляют окислительных свойств);
4. Каждый металл ряда, не разлагающий воду, вытесняет металлы, имеющие более положительные значения электродных потенциалов из растворов их солей;
5. Чем больше отличаются металлы значениями электродных потенциалов, тем большее значение э.д.с. будет иметь построенный из них гальванический элемент.
|
|
|
Зависимость величины электродного потенциала (Е) от природы металла, активности его ионов в растворе и температуры выражается уравнением Нернста
ЕМе = ЕоМе + RTln(aМеn+)/nF,
где ЕоМе – стандартный электродный потенциал металла, aMen+ – активность ионов металла в растворе. При стандартной температуре 25 оС, для разбавленных растворов заменяя активность (а) концентрацией (с), натуральный логарифм десятичным и подставляя значения R, T и F, получим
ЕМе = ЕоМе + (0,059/n)lgс.
Например, для цинкового электрода, помещенного в раствор своей соли, концентрацию гидратированных ионов Zn2+× mH2O сокращенно обозначим Zn2+ , тогда
ЕZn = ЕоZn + (0,059/n) lg[ Zn2+].
Если [Zn2+] = 1 моль/дм3, то ЕZn = Е оZn.
 2015-08-13
2015-08-13 1363
1363








