Атом — одноядерная, химически неделимая частица хим.элемента, носитель свойства в-ва. Из атомов состоят в-ва. Сам атом состоит из положительно заряженного ядра и отрицательно заряженного электронного облака. В целом атом электронейтрален. Размер атома полностью определяется размером его электронного облака, поскольку размер ядра ничтожно мал по сравнению с размером электронного облака. Ядро состоит из Z положительно заряженных протонов (заряд протона соответствует +1 в условных единицах) и N нейтронов, которые не несут на себе заряда (протоны и нейтроны называют нуклонами). Таким образом заряд ядра определятся только количеством протонов и равен порядковому номеру элемента в табл. Менделеева. Положит.заряд ядра компенсируется отрицательно заряженными электронами (заряд электрона -1 в условных единицах), кот-е формируют электронное облако. Таким образом количество электронов равно количеству протонов. Массы протонов и нейтронов равны (соответственно 1 и 1 а.е.м.). Масса атома определятся массой его ядра, поскольку масса электрона примерно в 1850 раз меньше массы протона и нейтрона и в расчетах редко учитывается. Количество нейтронов можно узнать по разности между массой атома количеством протонов (N=A-Z). Силы, удерживающие нуклоны в ядре, наз. ядерными. Они определяются самым интенсивным из всех известных в физике взаимод. (сильное взаимод.); для двух протонов в ядре, напр., ядерные силы примерно в 100 раз превышают электростатич. отталкивание. Важным св-вом ядерных сил является их независимость от заряда нуклона; взаимод. двух протонов, двух нейтронов или протона и нейтрона одинаковы, если одинаковы состояния относит. движения этих пар частиц, а также спиновые состояния. Для расщепления ядра атомного на отдельные нуклоны необходимо затратить энергию, наз. энергией связи ядра Есв, определяемую соотношением: ECB = (Zmp + Nmn-M)c2, где mp, тпи М - массы протона, нейтрона и ядра соотв.; с - скорость света.
|
|
|
В 1924 году французский физик Луи де Бройль предположил, что двойственная, корпускулярно-волновая природа свойственна не только фотонам, но и к электрону. Электрону как волне присущи волновые явления дифракции. Математический дуализм волна-частица выражается уравнением Луи де Бройля: 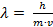 , где λ − длина волны, h – постоянная Планка (6,63·10-34 Дж/с), m − масса частицы, v − скорость частицы. Уравнение легко выводится, если в уравнение Планка E = h· υ ( υ - частота), подставить значение E из уравнения Эйнштейна Е = m ·с2 -> m · c2 = h · υ -> υ = c/ λ -> m · c2 = h · с/λ -> m · c2 = h /λ -> λ = h /m·с, заменив с – (скорость фотона) на скорость любой микрочастицы v.
, где λ − длина волны, h – постоянная Планка (6,63·10-34 Дж/с), m − масса частицы, v − скорость частицы. Уравнение легко выводится, если в уравнение Планка E = h· υ ( υ - частота), подставить значение E из уравнения Эйнштейна Е = m ·с2 -> m · c2 = h · υ -> υ = c/ λ -> m · c2 = h · с/λ -> m · c2 = h /λ -> λ = h /m·с, заменив с – (скорость фотона) на скорость любой микрочастицы v.
|
|
|
В квантовой механике поведение микрочастиц описывается волновым уравнением Шрёдингера, являющимся математической записью основного закона их движения. Австрийский учёный Эрвин Шрёдингер в уравнение стоячей волны подставил вместо длины волны её значение из уравнения Луи де Бройля и получил уравнение волнового движения, связывающее энергию электрона с пространственными координатами и переменной величиной ψ (пси) − волновой функцией. 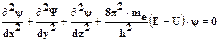 ψ=f(x,y,z),где, m – масса электрона, h – постоянная Планка, Е – полная эн. электрона, U – потенц. эн. электрона.
ψ=f(x,y,z),где, m – масса электрона, h – постоянная Планка, Е – полная эн. электрона, U – потенц. эн. электрона.
Уравнение Шрёдингера описывает состояние электрона в атоме. Из уравнения следует, что изменение волновой функции ψ зависит от полной энергии E, от потенциальной энергии U и от координат (x,y,z).
Волновую функцию, или амплитуду, электронной волны, называют также орбиталью. Величина ψ может как и амплитуда любого волнового процесса иметь знак + и −, т.е. находиться на положительной и отрицательной оси. Но ψ 2 всегда положительная.
Физический смысл ψ выражает вероятность нахождения электрона в данном месте пространства, причём вероятность характеризуют квадратом этой функции, поскольку вероятность не может быть отрицательной величиной. Т.е. орбиталь это ψ − функция электрона. ψ равна нулю там, где электрон не может находиться.
Изучение атомных спектров и химических свойств элементов показало, что электроны в атоме распределяются по энергетическим уровням (энергетическое состояние электрона характеризуется квантовыми числами).
 2015-08-12
2015-08-12 1364
1364







