Окислительно-восстановительное титрование.
Red/Ox потенциалы. Характерная особенность ОВР – передача ē-ов м\у ре-агирующими в-вами. Окислитель-ч-ца, принимающая ē, восстановитель–ч-ца, отдающая ē. Закон электро-нейтральности: число ē-ов, отдаваемых восстановите-лем, дб = числу ē-ов, принимаемых окислителем. ЭДС =Еох–Еred (измеряется потенциометром). Каждый электрод представляет собой систему из окисленной и восстановленной формы исх. в-ва (Red/Ox пара) и обозначается, н., Fe3+/Fe2+. Потенциал (Е) каждой Red/Ox пары измерить невозможно, можно лишь определить относительные характеристики, измеряя лишь Е данного электрода относительно другого, взя-того условно за стандарт (водородный электрод). Во-дородный электрод–губчатая (платинированная) Рt поглощает газообр. H2 и электрод действует так, будто он состоит из газообр. H2, находящегося в равновесии с Н+:H2(г)↔2Н++ 2ē. Электрод омывается газообр. Н2 при р=1 атм. и погружен в р-р к-ты с а=1. Естанд. водородного электрода принят = 0 при всех Т°. Если электрод комбинировать со стандартным, то ЭДС=Е1 – Е2, Е2=0, ЭДС=Е1. Т.о., Е1 состоит из ЭДС и Е0. Зави-симость ЕRed/Ox от С и Т° передается ур-ем Нернста: Е=Е0+(RT/nF)*ln(aOx/aRed), где Е0-станд. Red/Ox потен-циал, R-универсальная газовая const, Т-абсолютная температура, F-const Фарадея, n-число ē-ов, принима-ющих участие в р-ции, а Red/Ox-активность Ox и Red формы данного в-ва. аi=Ci*ji. Если все участники полур-ции нах-ся в станд. сост-ии, т.е. растворенные в-ва в гипотетическом 1 М р-ре, в котором их j=1, а чистые в-ва нах-ся в наиболее устойчивом физ. состо-янии при данных Т и р, то
|
|
|
ln(aOx/aRed)=ln[([Ox]*jOx)/([Red]*jRed)] => E=E0.
При подстановке всех const и переходе к Т=25°С и lg:
Е=Е0+(0,059/n)*lg(aOx/aRed)=E0+(0,059/n)*lg([Ox]/[Red])+(0,059/n)*lg(jOx/jRed]). Формальный потенциал Red/Ox пары: Е0(‘)=E0+(0,059/n)*lg(jOx/jRed]). В отличие от ионной силы р-ра он может меняться. Е0(‘)-Е системы, в которой конц-ии всех участников = 1 моль/л. если пренебречь эффектом ионной силы, то Е0(‘) совпадает с Е0. Для многих хим.-аналит. расчетов такого приближения достаточно.
Е0 Red/Ox системы – объективная хар-ка силы данного Ох или Red. Чем более положительное значение Е, тем более сильным является Ох. Т.о., на основании величин Е0 можно предвидеть направление хим. р-ций. На практике это, однако, не всегда оправдывается, т.к. активности компонентов р-ции не всегда = 1. Кроме того, потенциалы Red/Ox пар зависят от кислотности р-ра и др. факторов.
Константы равновесия Red/Ox р-ций. В любой Red/Ox р-ции есть 2 Red/Ox пары:Ox1/Red1 и Ox2/Red2. аOx1+bRed2↔aOx2+bRed1; K=[aa(Red1)*ab(Ox2)]/[aa(Ox1)*ab(Red2)].
Ур-е Нернста для обеих Red/Ox пар:
ЕOx1/Red1=Е0Ox1/Red1+(0,059/n)*lg(aaOx1/ aaRed1),
ЕOx2/Red2=Е0Ox2/Red2+(0,059/n)*lg(abOx2/ abRed2),
n-число принимаемых и отдаваемых ē.
В условиях равновесия: ЕOx1/Red1= ЕOx2/Red2.
|
|
|
(Е0Ox1/Red1- Е0Ox2/Red2)*n/0,059= lg(aaRed1*abOx2)/(aaOx1*abRed2)=lgK0, где К0-термодинами-ческая const равновесия.
lgK0=(Е0Ox- Е0Red)*n/0,059; Е0Ox, Е0Red – стандартные потенциалы пар. Чем больше (Е0Ox- Е0Red), тем больше К0 и тем полнее будет протекать р-ция слева направо при прочих равных условиях.
IndОх+ nē+aH+↔ IndRed (в кислой среде)=>
Ex=E0+(0,059/n)*lg(aOx*aH+/aRed).
При проведении Red/Ox титр-я, как правило, исп-ся сильнокислая среда (H2SO4)=> кислотность среды сохраняется const, даже если в ходе р-ции поглощает-ся или выделяется протон. Примем, что [H+]=1моль/л, jOx=jRed=1. Ex(Ind)=E0+(0,059/n)*lg([Ox]/[Red]).
Ex=E0 ± (0,059/n), т.к. [Ox]/[Red]=0,1–1,0. Для боль-шинства Red/Ox Ind n=2 => Ex=E0±0,3.
В качестве обратимых Red/Ox Ind используются в-ва, у которых чаще всего 1 форма окрашена, а др. – б/цв. Н., дифениламин. Процесс его окисления проходит в 2 стадии: 1-я-необратимая, 2-я-обратимая.
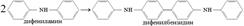
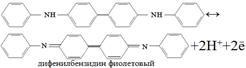
Появление окраски связано с биноидными кольцами. ДФА плохо растворим в воде и растворим в конц. H2SO4. => Применяют дифениламиносульфок-ту, ее соли с Ва или Na, которые хорошо растворимы в H2O
 2015-08-12
2015-08-12 731
731








