2 Глинка Н.Л. Общая химия. М., 1990. Глава 9, с. 263-284;
3. Равич-Щербо М.И., Новиков В.В. Физическая и коллоидная химия. М.,1975 Часть 1, глава 3, с. 52-75
4. Рубина Х.М. и др. Практикум по физической и коллоидной химии. М., 1972. Глава 3, с. 39-42
7. Контроль:
Задачи и упражнения:
№1. Вычислить потенциал медного электрода при 180С, погруженного в раствор своей соли с концентрацией 0,1 моль/л. е0Сu= +0,34 В.
№2. Вычислить на сколько изменится потенциал цинкового электрода, если 1 М раствор ZnSO4 разбавить в 10 раз. е0Zn = - 0,76 В.
№3. Записать схему медно-свинцового гальванического элемента при стандартных условиях е0Сu = +0,34 В. е0Рb= -0,13 В.
№4. Вычислить при 250С потенциал водородного электрода погруженного в дистиллированную воду.
№5. Определить ЭДС медно–цинкового гальванического элемента при 180С, если концентрация ионов меди равна 0,1 моль/л, концентрация ионов цинка равна 0,001 моль/л, нормальный потенциал меди равна 0,34 B, нормальный потенциал цинка равен –0,76 В.
Тестовые задания: Электродные потенциалы. Окислительно–восстановительные потенциалы. Потенциометрия в медицинской практике.
|
|
|
1. Нормальный (стандартный) потенциал любого электрода равен Э.Д.С. элемента составленного из данного электрода, в растворе которого активность ионов металла равна 1 моль/л и
1. насыщенного каломельного электрода
2. нормального водородного электрода, в растворе которого а (Н+) =1
3. насыщенного хлорсеребряного электрода
4. любого металлического электрода, в растворе которого а (Меn+) =1
5. хингидронного электрода
2. Потенциометрический метод определения рН основан на том, что измеряют Э.Д.С. элемента, состоящего из вспомогательного электрода с известным потенциалом, и электрода,
1. потенциал которого зависит от концентрации водородных ионов
2. потенциал которого не зависит от концентрации водородных ионов
3. потенциал которого не зависит от температуры и рН раствора
4. потенциал которого зависит от температуры, но не зависит от рН раствора
5. выполненного из активного металла, например натрия
3. Укажите, какой заряд может быть на металлической пластине, погруженной в раствор своей соли
1. только отрицательный
2. только положительный
3. только равным нулю
4. положительным, отрицательным и равным нулю
5. заряд на пластине при погружении её в раствор соли не возникает
4. От концентрации водородных ионов в растворе не зависит потенциал
1. хингидронного электрода
2. водородного электрода
3. стеклянного электрода
4. каломельного электрода
5. правильного ответа нет
5. Укажите электрод, потенциал которого зависит от рН среды электрода
1. каломельного
2. цинкового
3. хлорсеребряного
|
|
|
4. медного
5. стеклянного
6. Деполяризацией электродов называется процесс
1. возникновения потенциала на электроде
2. устранения поляризации электрода
3. возникновения потенциала за счет изменения химической природы электрода
4. изменения потенциала, вызванный изменением концентрации ионов в растворе
5. изменения потенциала за счет изменения химической природы среды
7. В методе потенциометрического титрования для определения концентрации кислот и щелочей производят измерение
1. электропроводности раствора
2. сопротивления раствора
3. эквивалентной электропроводности раствора
4. электродвижущей силы гальванического элемента, состоящего из электрода сравнения и электрода определения
5. удельной электропроводности раствора
8. Укажите неправильное суждение о водородном электроде. Водородный электрод
1. - это стеклянный сосуд, в который впаяна платиновая пластина
2. имеет платиновую пластинку, покрытую мелкодисперсной или губчатой
платиной и опущенную в раствор серной кислоты с N = 1 моль/л
3. - это сосуд, заполненный раствором серной кислоты с молярной концентрацией эквивалента равной 1 моль/л
4. при стандартных условиях имеет электродный потенциал равный нулю
5. можно использовать только в паре с каломельным электродом 
9. Уравнение 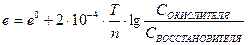 это
это
1. уравнение для определения электродвижущей силы гальванического элемента
2. математическая запись правила Вант-Гоффа
3. уравнение Нернста для определения потенциала окислительно-восстановительного электрода
4. формула для расчета массы эквивалента окислителя и восстановителя
5. формула для расчета степени окисления элементов в уравнениях окислительно-восстановительных реакций
10. При контакте двух растворов, которые отличаются концентрацией или природой растворенного вещества,
1. образуется буферный раствор
2. возникает осмотическое давление
3. возникает диффузионный потенциал
4. образуется комплексное соединение
5. происходит взаимная коагуляция
11. При погружении металла в чистую воду, на металле возникает заряд
1. отрицательный
2. положительный
3. равный нулю
4. в зависимости от активности металла: положительный, отрицательный или равный нулю
5. заряд на металле, погруженном в воду не возникает
12. Скачок потенциала на границе между различными по составу или по концентрации растворами называется
1. стандартным потенциалом
2. водородным электродом
3. диффузным потенциалом
4. мембранным потенциалом
5. электродвижущей силой гальванического элемента
13. Методы потенциометрического титрования по реакциям нейтрализации, осаждения, окисления-восстановления и комплексообразования основаны
1. на плавном изменении потенциала вблизи эквивалентной точки
2. на резком изменении потенциала вблизи эквивалентной точки
3. на прямой зависимости потенциала от активности потенциалобразующего иона
4. на полной независимости потенциала от активности потенциалобразующего иона.
5. на изменении окраски титранта вблизи эквивалентной точки
14. Укажите, в каких случаях в уравнениях для расчета величины электродного потенциала можно вместо активности использовать величину концентрации
1. в любом случае
2. в сильно концентрированных растворах
3. в разбавленных растворах
4. нельзя никогда при вычислениях пользоваться концентрацией вместо активности
5. при стандартных условиях
15.Дифференциальные кривые потенциометрического титрования строятся
1.в том случае, когда проводится титрование по реакциям нейтрализации, где в эквивалентной точке скачок потенциала практически мало различим
2.в любом случае потенциометрического титрования для более точного определения точки эквивалентности
3.только при проведении титрования по реакциям комплексообразования
|
|
|
4.при титровании по реакциям окисления-восстановления
5.только при проведении титрования по методу осаждения
16.Укажите, как изменяется потенциал металлического электрода, погруженного в раствор своей соли, если концентрацию соли увеличить
1.не изменяется
2. уменьшается
3. увеличивается
4. сначала уменьшается, а затем увеличивается
5. принимает значение равное нулю и далее не изменяется
17.Металл, погруженный в раствор электролита, например, в раствор своей соли, представляет собой токопроводящую систему, которую в электрохимии называют
1.индикатором
2. электродом
3. электролитической ячейкой
4. адсорбентом
5. катарометром
18. При погружении в раствор своей соли отдавать катионы в раствор и заряжаться отрицательно способны
1. все металлы независимо от их активности
2. только металлы, стоящие в ряду напряжений после водорода
3. только химически активные металлы 4. водород и пассивные металлы
5. металлы способны заряжаться только положительно
19. Укажите, в каких реакциях водородный электрод служит индикаторным электродом
1. в реакциях окисления-восстановления
2. в реакциях нейтрализации
3. в реакциях осаждения
4. в реакциях комплексообразования
5. во всех перечисленных типах реакций
20. Укажите электрод, потенциал которого не зависит от рН среды
1. хингидронный
2. водородный
3.каломельный
4.стеклянный
5.нет правильного ответа
21. Укажите процесс, который протекает на аноде в элементе Даниэля-Якоби
(-)Zn|ZnSO4||Cu SO4|Cu(+), где е0 (Zn0 /Zn2+) = -0,76 В, е0 (Cu0 /Cu2+= +0,34 В,
- Zn2+ + 2
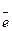 → Zn0
→ Zn0 - 2. Cu2+ + 2
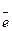 → Cu0
→ Cu0 - 3. Zn0 - 2
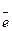 → Zn2+
→ Zn2+
4. Cu0 - 2 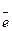 → Cu2+
→ Cu2+
5. Zn0 + 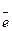 → Zn-
→ Zn-
22.Укажите, в каких случаях в уравнениях для расчета величины электродного потенциала можно вместо активности использовать величину концентрации
1. в любом случае
2. в сильно концентрированных растворах
3. в разбавленных растворах
4. нельзя никогда пользоваться концентрацией вместо активности
5. при стандартных условиях
23. Укажите процесс, который протекает на катоде в элементе Даниэля-Якоби
|
|
|
(-)Zn|ZnSO4||Cu SO4|Cu(+), где е0 (Zn0 /Zn2+) = -0,76 В, е0 (Cu0 /Cu2+= +0,34 В,
- Zn2+ + 2
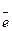 → Zn0
→ Zn0 - Cu2+ + 2
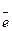 → Cu0
→ Cu0 - Zn0 - 2
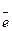 → Zn2+
→ Zn2+
4. Cu0 - 2 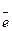 → Cu2+
→ Cu2+
5. Zn0 + 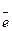 → Zn-
→ Zn-
24. У малоактивных металлов (ртуть, серебро, золото) при погружении в раствор их солей идет осаждение катионов соли из раствора на металл, в результате заряжается
1. металл – положительно, раствор – отрицательно
2. металл - отрицательно, раствор – положительно
3. металл – положительно, раствор – положительно
4. металл - отрицательно, раствор - отрицательно
5. и металл, и раствор приобретают заряд равный нулю
25. Потенциал каломельного электрода, обратимого относительно аниона, определяют по уравнению:
1. 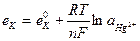
2. 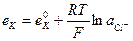
3. 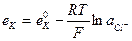
4. 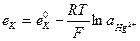
5. 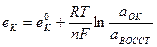
26. Электродные потенциалы железа и меди соответственно равны -0,44 В и +0,34 В. Электродвижущая сила гальванического элемента из этих электродов равна:
1. -0,78 B
2. +0,10 В
3. +0,78 В
4. -0,10 В
5. +1,29 В
27. Стандартные электродные потенциалы магния и меди соответственно равны -2,36 В и +0,34 В. Электродвижущая сила медно-магниевого гальванического элемента при данных условиях равна:
1. -2,02 В
2. +2,70 В
3. +2,02 В
4. -2,70 В
5. нет правильного ответа
28. ЭДС элемента, составленного из насыщенного каломельного электрода и водородного: заполненного исследуемым раствором, при 180С равна 0,2528В. Потенциал насыщенного каломельного электрода равен 0,2483В. рН исследуемого раствора равен:
1. 1,0766
2. 0,0776
3. 2,0776
4. 1,1776
5. 2,1776
29. ЭДС гальванического элемента составленного из водородного и насыщенного каломельного электродов, при 250 С равна 0,760 В. Потенциал насыщенного каломельного электрода при 250С равен 0,2438 В. Водородный показатель раствора равен:
1.8,744
2. 9,744
3. 7,744
4. 0,760
5. 0,2438
30. Электродвижущая сила гальванического элемента составленного из цинкового и ртутного электродов равна 1,62 В. Стандартный электродный потенциалы ртути равен:
1. -0,86 В
2. +0,76 В
3. -1,62 В
4. +0,86 В
5. +1,62 В
 2015-08-21
2015-08-21 693
693







