АРОМАТИЧЕСКИЕ ГЕТЕРОЦИКЛЫ
1. Нарисуйте орбитальные картины для молекул пиридина, фурана, пиррола, и тиофена.
ОТВЕТ
Атом азота как и атомы углерода в пиридине sp2 гибридизирован и имеет один электрон на р орбитали, перпендикулярной плоскости кольца. Таким образом, один электрон атома азота вместе с пятью электронами атомов углерода образуют ароматическое p облако. Неподеленная электронная пара азота лежит в плоскости кольца на sp2 орбитали. Из-за подобия в связывании пиридин схож с бензолом и по строению: он планарен с близкой к идеальной гексагональной геометрией. Подобно бензолу пиридин ароматичен и более склонен к реакциям замещения, чем присоединения.
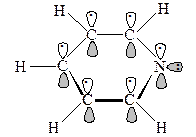
Фуран имеет планарную пентагональную структуру, в которой все атомы кольца sp2 гибридизованы. Каждый атом кольца использует две из этих орбиталей для образования s связей с соседними атомами кольца. Каждый атом углерода использует одну sp2 орбиталь, давая s связь в плоскости кольца с атомом водорода и имеет один электрон на р орбитали, перпендикулярной плоскости кольца. Атом кислорода имеет неподеленную электронную пару на sp2 орбитали в плоскости кольца и два электрона на р орбитали, перпендикулярной плоскости кольца. Эти два электрона перекрываются с электронами на р орбиталях атомов углерода, образуя 6p электронное облако выше и ниже плоскости кольца как в бензоле. Связывание в тиофене и пирроле аналогично. Важное различие между пяти- и шестичленными ароматическими гетероциклами состоит в том, что в пятичленных гетероциклах гетероатом отдает в ароматическую 6p систему два электрона, а в шестичленных – только один. Это различие имеет важные последствия в химическом поведении этих двух типов гетероциклов.
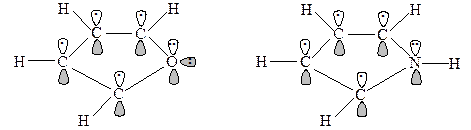
2. Свободная электронная пара атома азота в пирроле находится на орбитали
A) sp2 орбитали
B) sp3 орбитали
C) p орбитали
D) sp орбитали
ОТВЕТ
Свободная электронная пара атома азота в пирроле находится на p орбитали.
3. Предложите объяснение наблюдающейся основности пиррола (рКа -4.4), пиридина (рКа 5.29) и пирролидин (рКа 11.31).
ОТВЕТ
Пирролидин является циклическим вторичным амином. Пиридин – третичный амин, но он является существенно более слабым основанием (рКа = 5.29), чем алифатические амины (рКа @ 10). Это связано, в основном, с различной гибридизацией атома азота: sp2 – в пиридине, sp3 – в алифатических аминах. Больший s характер (1/3s – в пиридине, 1/4s – в алифатических аминах) приводит к тому, что неподеленная пара удерживается прочнее ядром атома азота в пиридине, понижая его основность. В пиридине неподеленная электронная пара не является частью ароматической p системы и доступна для присоединения протона. Хотя по структурным критериям пиррол – амин, его основность приблизительно в 1010 меньше, чем у пиридина. В пирроле неподеленная электронная пара азота является частью ароматической 6p электронной системы. Протонирование атома азота разрушило бы ароматическую систему с потерей ее энергии резонанса. Следовательно, пиррол – очень слабое основание; более того - в очень сильных кислотах он протонируется по атому углерода, а не по атому азота.
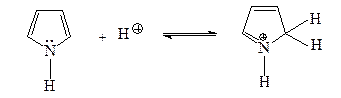
4. Получите 2,5-диметилфуран (А) из этилацетата и других необходимых реагентов.
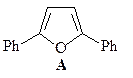
ОТВЕТ
Синтез уранов по Паалю-Кнорру.
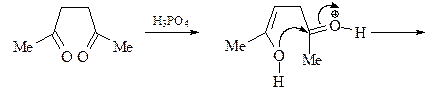
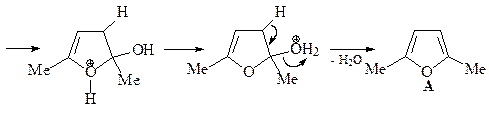
Синтез исходного дикетона
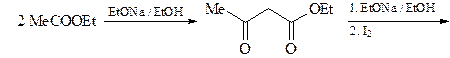
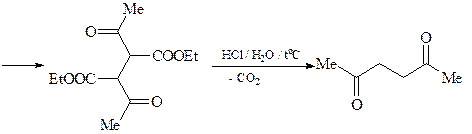
5. Из ацетоуксусного эфира, пинаколина и других необходимых реагентов получите 2-метил-5- трет -бутилфуран (А).
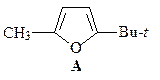
ОТВЕТ
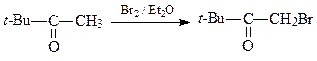
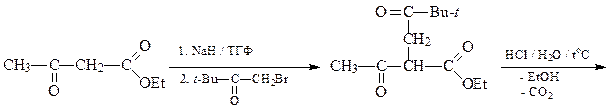
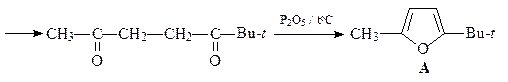
6. Из циклогексанона, пирролидина, бромацетона и других необходимых реагентов получите замещенный фуран А.
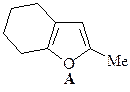
ОТВЕТ
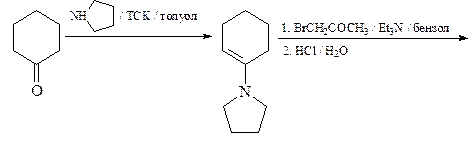
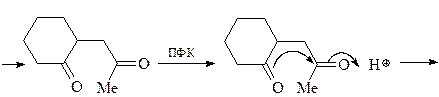
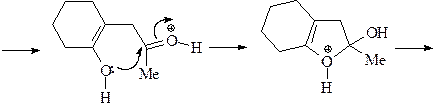
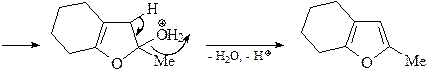
7. Получите 1-метил-2,5-дифенилпиррол (А) из метиламина, этилбензоата, этилацетата и других необходимых реагентов.
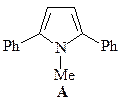
ОТВЕТ
Синтез пиррола по Паалю-Кнорру. Реакцию проводят при комнатной температуре: в качестве растворителей можно использовать H2O, ROH, RCOOH, C6H6.
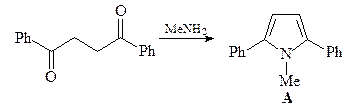
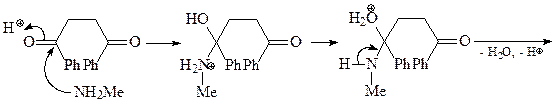
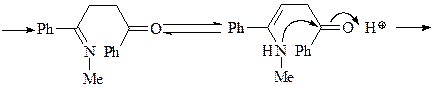
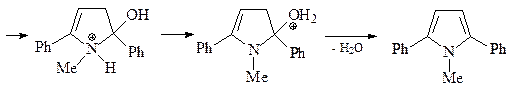
Синтез исходного дикетона
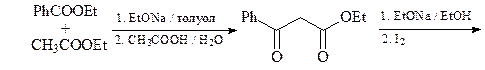
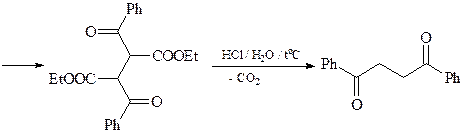
8. Синтезируйте соединение А, исходя из адипиновой кислоты, бромацетона и метиламина.
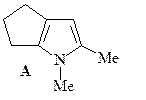
ОТВЕТ
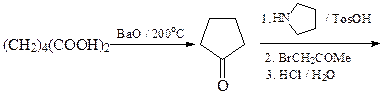
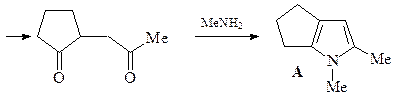
9. Получите гетероцикл А из пиридина, ацетилена, ацетальдегида и других необходимых неароматических реагентов.
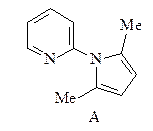
ОТВЕТ
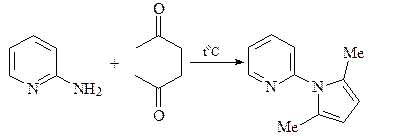
10. Исходя из ацетофенона и диэтилового эфира адипиновой кислоты осуществите синтез соединения А.
ОТВЕТ
Синтез тиофена по Паалю-Кнорру.
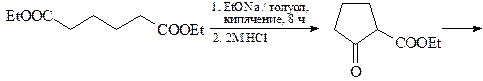
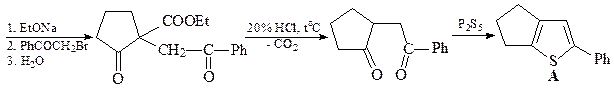
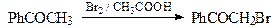
11. Реакции электрофильного замещения для фурана, пиррола и тиофена проходят преимущественно в положение С-2, а если это положение занято, то в положение С-5. Объясните этот факт. Нарисуйте резонансные структуры для промежуточного s-комплекса, который образуется при атаке в положения С-2 (С-5) и С-3 (С-4). Приведите основной продукт и объясните причину его образования.
ОТВЕТ
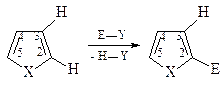
Электрофильная атака в положение С-2 (или в положение С-5) преобладает, так как в этом случае в карбокатионном промежуточном s-комплексе положительный заряд может быть делокализован по трем атомам, в то время как атака по С-3 (С-4) дает возможность делокализации только по двум положениям.
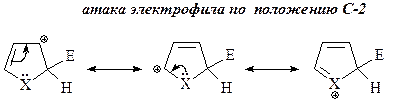
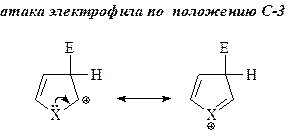
X = NH, S, O
12. Приведите условия приведенных ниже реакций.
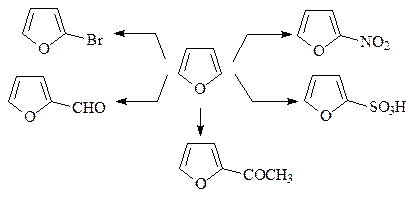
ОТВЕТ
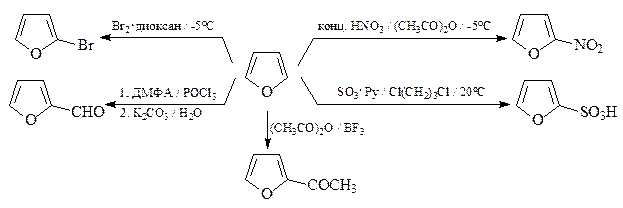
13. Из фурана и других необходимых реагентов синтезируйте фурфуриловый спирт.
ОТВЕТ
На первой стадии нужно использовать реакцию Вильсмейера, а на второй – перекрестную реакцию Канниццаро.
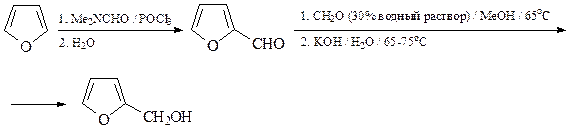
14. Приведите структуру соединения А, получающегося в результате следующей реакции.
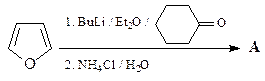
ОТВЕТ
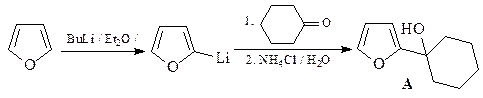
15. В нижеприведенной схеме укажите структуры соединений А - В.
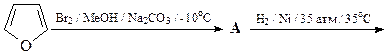
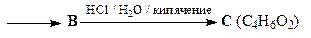
ОТВЕТ
Взаимодействие брома с фураном протекает через образование 1,4-аддукта I, который был зафиксирован с помощью спектроскопии ЯМР при низких температуре. При комнатной температуре гладко образуется 2-бромфуран. Если реакцию фурана с бромом проводить в присутствии метанола, то интермедиат улавливается в виде диметоксипроизводного А. Продукт восстановления соединения А – соединение В – является ацеталем диальдегида, поэтому под действием кислоты превращается в диальдегид С (янтарный альдегид).
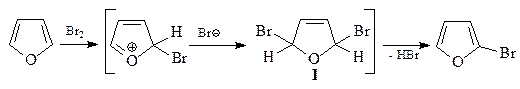
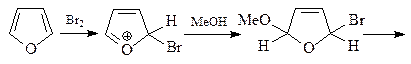
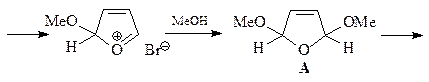
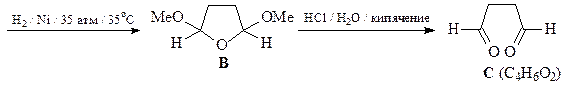
16. Приведите строение соединения А, которое образуется при обработке 2,5-диметилфурана одним эквивалентом диметилового эфира ацетилендикарбоновой кислоты.
16. ОТВЕТ
Фуран склонен к образованию продуктов присоединения в качестве 1,3-диена, в частности, циклоаддуктов Дильса-Альдера.
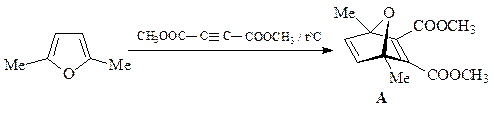
17. Напишите структуру продукта А нижеприведенной реакции.
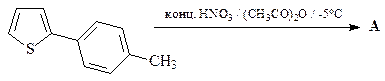
ОТВЕТ
Тиофен более активен по сравнению с бензолом в реакциях электрофильного ароматического замещения.
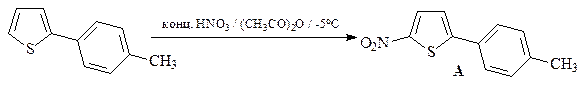
18. Предложите два метода синтеза 5-этилтиофен-2-карбоновой кислот, исходя из тиофена и других необходимых реагентов.
ОТВЕТ
Первый способ
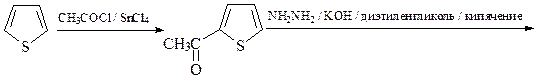
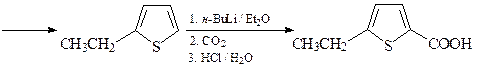
Второй способ
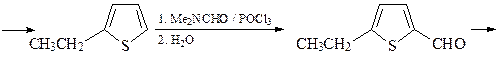
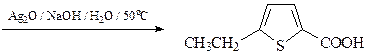
19. Исходя из метилфурана и других необходимых реагентов, получите, используя реакцию Юрьева, 1,2-диметилпиррол. Напишите структуру продукта реакции монобромирования 1,2-диметилпиррола под действием диоксандибромида.
ОТВЕТ
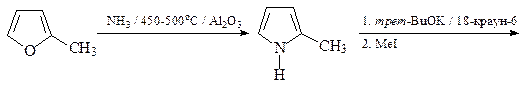
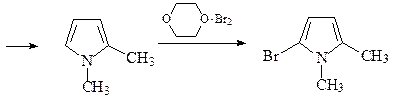
20. Предложите схему синтеза a-фурил-a-тиенилкетона, исходя из тиофена, фурфурола и других необходимых реагентов.
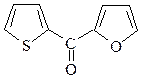
ОТВЕТ
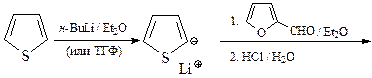
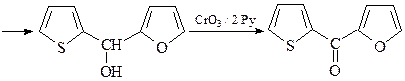
21. Расшифруйте цепочку превращений,
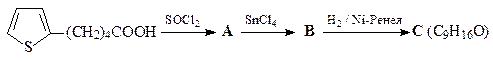
ОТВЕТ
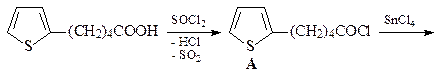
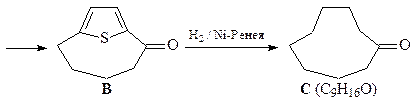
Превращение производного тиофена В в кетон С под действием Ni-Ренея в инертном растворителе – реакция восстановительной десульфуризации. Поскольку тиофены с различными заместителями достаточно доступны, эта реакция является удобным методом синтеза насыщенных углеводородов. В приведенной выше схеме показана возможность применения восстановительной десульфуризации для синтеза кетонов больших циклов.
22. Исходя из формальдегида и ацетоуксусного эфира, получите 2,6-диметилпиридин А, используя синтез пиридинов по Ганчу.
ОТВЕТ
Первой стадией синтеза Ганча является конденсация Кневенагеля с участием ацетоуксусного эфира и формальдегида с образованием a,b-ненасыщенного кетоэфира. Взаимодействие аммиака и ацетоуксусного эфира приводит к енамину. Далее происходит конденсация a,b-ненасыщенного кетоэфира и енамина, которая в результате нескольких стадий дает соответствующий 1,4-дигидропиридин В, который легко окисляется азотной кислотой, давая 2,6-диметил-3,5-(диэтоксикарбонил)пиридин С. Последующее декарбоксилирование соединения С приводит к 2,6-диметилпиридину А.
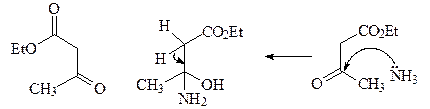
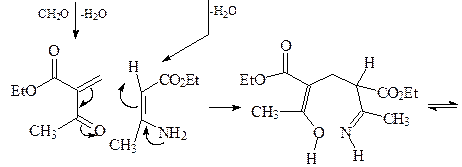
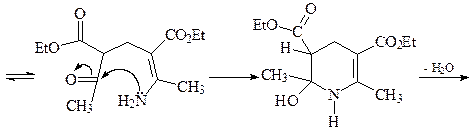
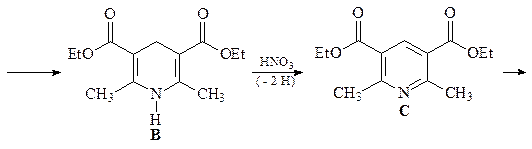
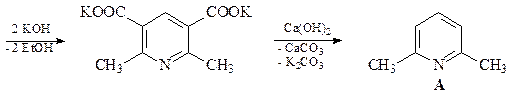
1,4-Дигидропиридины являются не только интермедиатами в синтезе пиридинов, но и представляют собой важный класс гетероциклов. Например, если в обсуждаемой конденсации формальдегид заменить на орто -нитробензальдегид, то получается нифедепин – высокоэффективное сердечно-сосудистое средство (антагонист кальция).
23. Синтезируйте 3-бензоилпиридин, исходя из пиридина.
23. ОТВЕТ
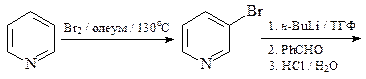
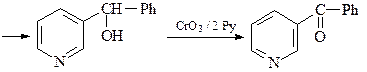
24. Укажите условия превращения пиридина: а) в 3-нитропиридин; б) в 3-бромпиридин.
ОТВЕТ
Реакции электрофильного замещения для пиридина протекают довольно трудно, так как пиридин является p-дефицитным гетероциклом. Реакционная способность пиридина в 106 раз меньше, чем бензола. Кроме того, в реакции электрофильного замещения при атоме углерода обычно вступают катионы пиридиния, реакционная способность которых по отношению к электрофилам существенно ниже, чем реакционная способность свободных оснований. Катион пиридиния образуется в результате быстрого кислотно-основного взаимодействия молекулы пиридина (основание Льюиса) с любой электрофильной частицей (кислота Льюиса).
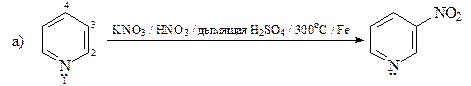
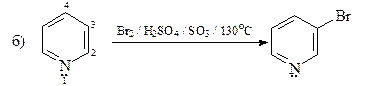
25. Нарисуйте структуры интермедиатов, образующихся в электрофильных атаках по положениям С-2, С-3 и С-4 кольца пиридина и объясните, почему замещение по положению С-3 является преобладающим.
ОТВЕТ
Атака электрофила по положению С-3 приводит к наиболее стабильным ионам: в этих интермедиатах С-2, С-4 и С-6 атомы кольца участвуют в делокализации положительного заряда пиридинониевого иона.
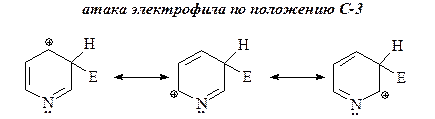
Напротив, в случае атаки электрофила по положениям С-2 и С-4 в одной из резонансных структур s-комплекса положительный заряд находится на более электроотрицательном атоме азота, что, очевидно, энергетически неблагоприятно.
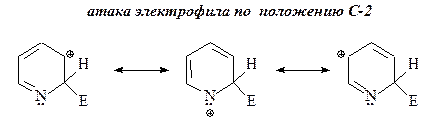
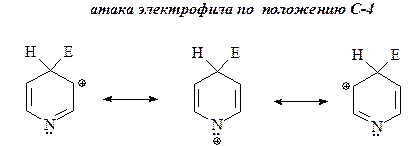
26. Напишите схемы превращения а) пиридина в 2-аминопиридин под действием амида натрия в жидком аммиаке и б) 4-хлорпиридина в 4-метоксипиридин при обработке метилатом натрия в метиловом спирте; сравните эту реакцию с взаимодействием 4-нитрохлорбензола с нуклеофильными реагентами.
ОТВЕТ
Введение атома азота в ароматическую 6p-электронную систему пиридина способствует протеканию нуклеофильного замещения, особенно по положениям С-2 (С-6) и С-4.
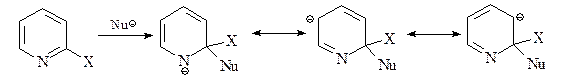
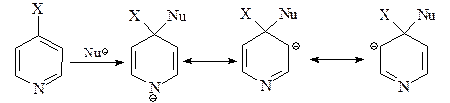
Атака по С-3/С-5 положениям энергетически неблагоприятна.
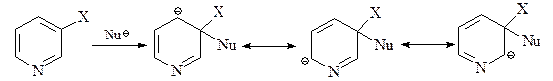
а) Реакция Чичибабина. Атака амид-иона по С-2 дает анионный интермедиат с отрицательным зарядом в основном на атоме азота.
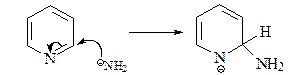
Для возвращения к ароматической системе гидрид-ион должен вытесниться. Он затем атакует аминогруппу, давая газ водород и анион амидного типа.
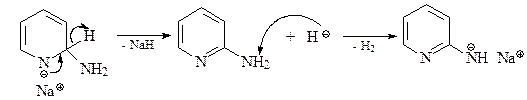
На последней стадии этот анион протонируется водой.
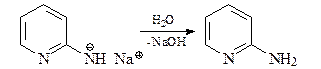
б) Нуклеофильное замещение в пиридине при переходе от гидрид-аниона к более легко уходящей группе – хлорид-аниону – протекает легче. Изомерные хлорпиридины заметно различаются по способности обменивать хлор на нуклеофильные группы. Например, 2- и 4-хлорпиридины легко реагируют с аммиаком, гидразином, первичными и вторичными аминами, MeONa и EtSNa, образуя соответствующие 2- и 4-замещенные пиридины. В то же время 3-хлорпиридин стабилен не только в сходных, но и в более жестких условиях. Реакция нуклеофильного замещения атома хлора в 3-хлорпиридине протекает по механизму отщепления–присоединения (ЕА) через дегидропиридин. В случае 4-хлорпиридина осуществляется механизм присоединения–отщепления (АЕ) – SNAr, как это имеет место для активированного к нуклеофильному замещению 4-нитрохлорбензола.
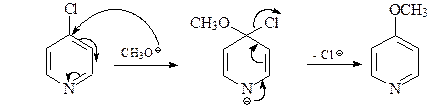
27. Приведите механизм превращения 2-хлорпиридина в 2-метоксипиридин.
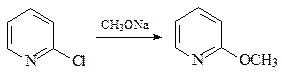
ОТВЕТ
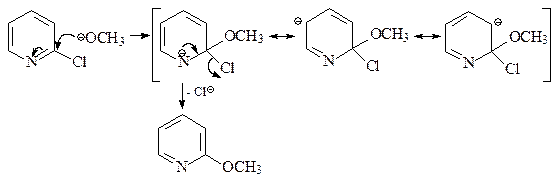
28. Укажите структуры соединений A - Е в приведенной ниже схеме.
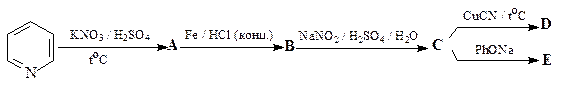
ОТВЕТ
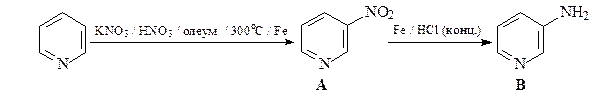
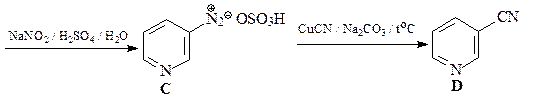
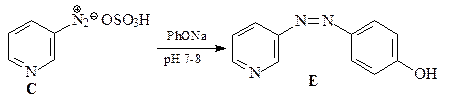
29. Расшифруйте приведенную ниже цепочку превращений.
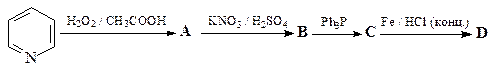
ОТВЕТ
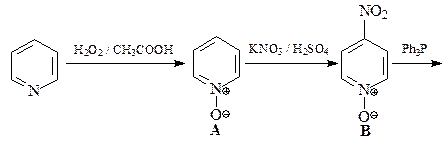
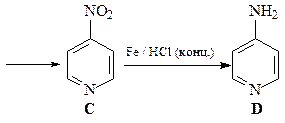
N-Оксиды пиридина более склонны к реакциям электрофильного замещения, чем сами пиридины. Это связывают с электронодонорным мезомерным влиянием атома кислорода N-оксида (похоже на влияние мезомерного эффекта кислорода в фенолах и фенолятах).

30. Приведите структуры соединений А и В в приведенной последовательности превращений.
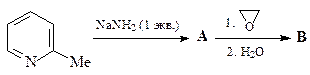
ОТВЕТ
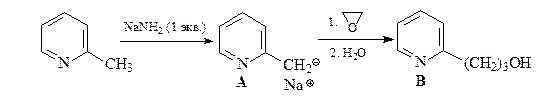
31. Расшифруйте приведенную ниже схему.
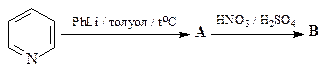
ОТВЕТ
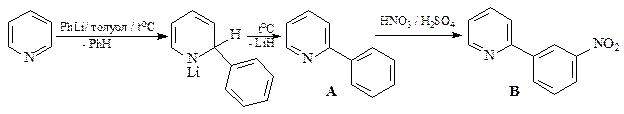
32. Исходя из пиридина осуществите синтез 2,5-дибромпиридина. Какой продукт получится при обработке этого соединения раствором одного эквивалента метилата натрия в метаноле?
ОТВЕТ
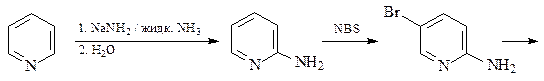
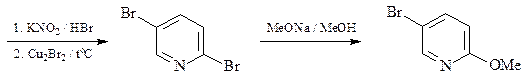
33 Обработка 4-бромпиридина NaNH2 / жидк. NH3 дает два изомерных соединения А и В с брутто-формулой C5Н6N2, а реакция с MeONa / MeOH приводит только к одному продукту – С ( C6Н7NO) Приведите структуры соединений А, В и С и схемы их образования.
ОТВЕТ
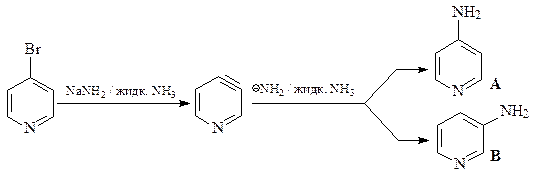
Образование соединений А и С в реакции нуклеофильного замещения проходит по механизму элиминирования-присоединения через промежуточное образование дегидропиридина.
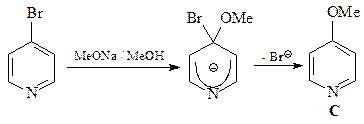
Образование только одного соединения в случае обработки 4-бромпиридина MeONa / MeOH говорит в пользу протекания этой реакции нуклеофильного замещения по механизму присоединения-элиминирования.
34. Получите 2- и 4-бромпиридины, исходя из пиридина.
ОТВЕТ
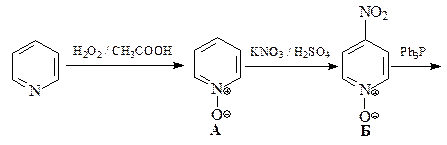
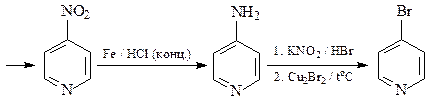
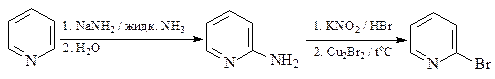
35.Исходя из пиридина и других необходимых реагентов, получите соединения пиридинового ряда A и В.
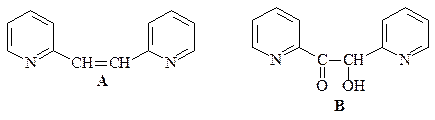
ОТВЕТ
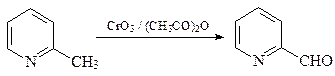
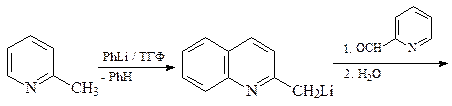
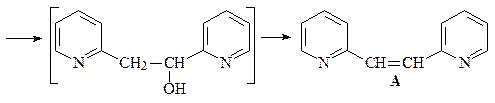
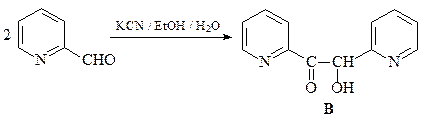
36. Получите 3-пиридинкарбоновую (никотиновую) кислоту А двумя способами: исходя из пиридина и исходя из хинолина.
ОТВЕТ
Первый способ
В промышленности для синтеза никотиновой кислоты применяют: окисление хинолина щелочным раствором KMnO4 с дальнейшим частичным декарбоксилированием 2,3- пиридиндикарбоновой (хинолиновой) кислоты;
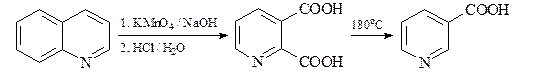
Карбоксигруппа у атома С-2 хинолиновой кислоты элиминируется легче (при 180°С), чем у атома С-3 никотиновой кислоты (при 260°С).
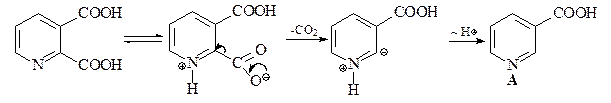
Второй способ
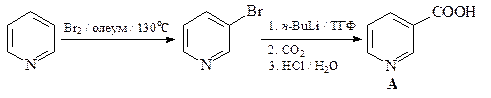
37. Какой a,b-непредельный кетон нужно ввести в реакцию с анилином (синтез Дебнера-Миллера), для того, чтобы получить 4-фенилхинолин?
ОТВЕТ
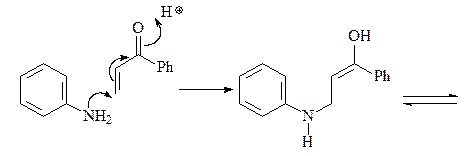
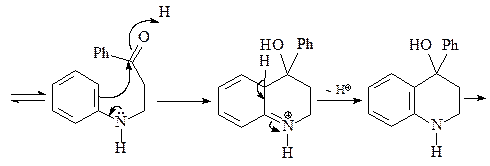
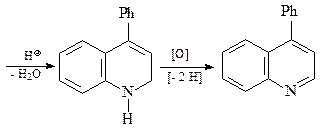
Синтез Дебнера-Миллера. В качестве конденсирующего агента используется соляная кислота или хлорид цинка. Реакция начинается с присоединения анилина к винилфенилкетону (реакция Михаэля) с образованием насыщенного альдегида, который циклизуется за счет реакции электрофильного ароматического замещения, давая соответствующий спирт. Катализируемая кислотой дегидратация промежуточного спирта и последующая реакция окисления дигидрохинолина приводит к целевому хинолину. В качестве окислителей можно использовать нитробензол, иод, пятиокись мышьяка а также соли трехвалентного железа.
38. Расшифруйте схему приведенной ниже реакции.
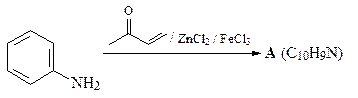
ОТВЕТ
Синтез 4-метилхинолина по Дебнеру Миллеру.
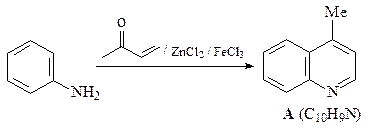
39. Приведите структуру соединения А в приведенной ниже схеме.
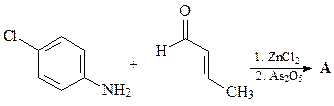
ОТВЕТ
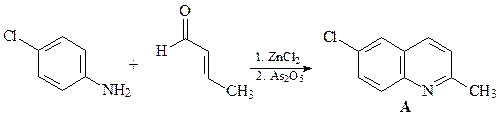
40. Синтезируйте 6-бромхинолин (А) из анилина и глицерина.
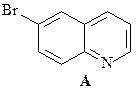
ОТВЕТ
Синтез Скраупа – реакция ариламинов с глицерином и серной кислотой в присутствии слабых окислителей (нитробензол, As2O5 и других). Предполагают, что в этой реакции из глицерина образуется акролеин, который далее взаимодействует с ариламином.
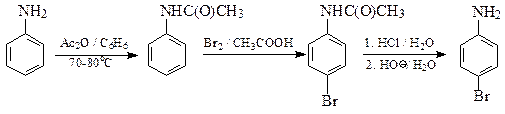
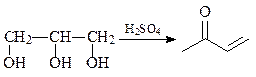
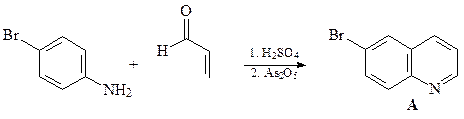
41.Из о -броманилина, гептандиаля и других необходимых реагентов получите замещенный хинолин А.
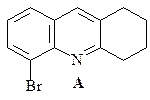
ОТВЕТ
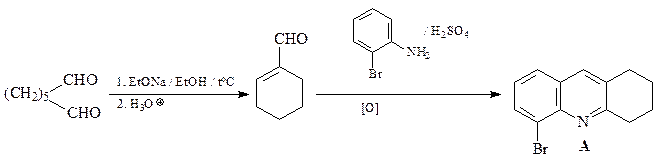
42. Приведите реагенты и условия реакций, необходимые для осуществления приведенного ниже превращения.
ОТВЕТ
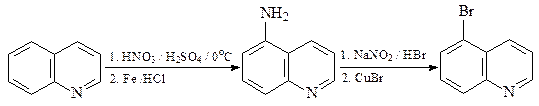
Реакции электрофильного замещения для хинолина электрофильного замещения идут легче, чем для пиридина, и при этом замещение идет по бензольному кольцу. Атом азота хинолина протонируется в кислых условиях нитрования, делая гетероциклическое кольцо устойчивым к электрофильной атаке. Наиболее чувствительны к электрофильной атаке атомы С-5 и С-8. Атака электрофила по С-5 (а также по С-8) протонированного хинолина дает катион, стабилизированный резонансом без нарушения ароматичности соседнего пиридинового цикла.
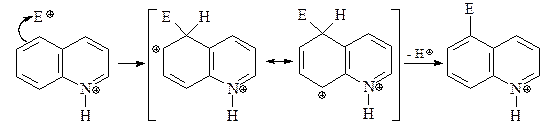
Атака электрофила по С-6 дает катион, для которого нет подобной стабилизации.
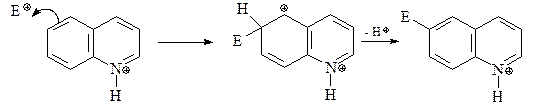
43. Сопоставьте свойства бензольного и пиридинового колец в хинолине. Напишите соответствующие уравнения реакций.
ОТВЕТ
Реакции электрофильного замещения
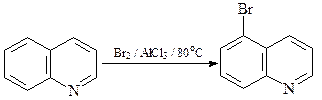
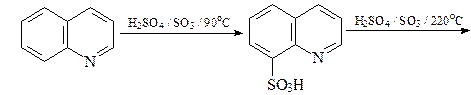
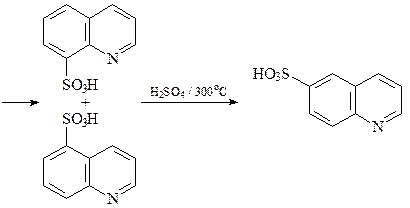
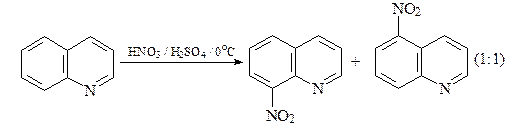
Реакции сульфирования и нитрования проходят с катионами хинолиния и приводят к продуктам замещения атомов водорода в бензольном кольце молекулы хинолина.
Реакции нуклеофильного замещения
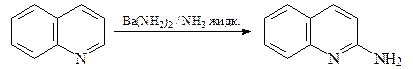
Аминирование хинолина (реакция Чичибабина) при нагревании с измельченным амидом натрия в диметиланилине при 110°С, как это проводят в случае пиридина приводит к 2-аминохинолину с низким выходом.
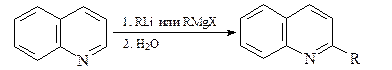
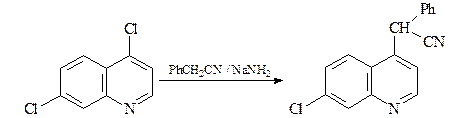
Селективное замещение атома хлора в положении С-4 пиридинового кольца протекает по механизму присоединения – элиминирования.
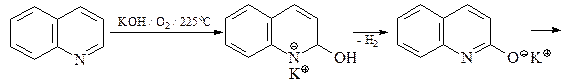
Реакция окисления бензольного кольца хинолина
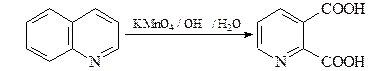
Реакция восстановления пиридинового кольца хинолина
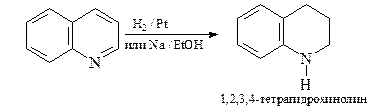
Свойства производных хинолина с алкильными заместителями
в положениях С-2 и С-4
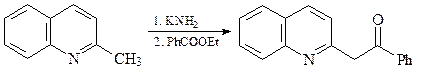
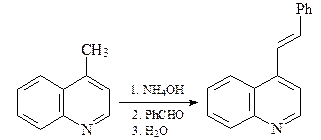
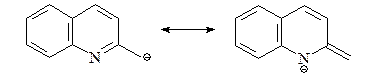
Алкильные группы в положениях С2 и С4 хинолина могут быть депротонированы под действием сильных оснований. Это связано с тем, что отрицательный заряд на карбанионе может быть делокализован (как и в случае пиридина) с участием электроотрицательного атома азота.

44. Получите 4-гидрокси-2-метилиндол (Е), исходя из 3-гидразинофенола и ацетона.
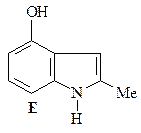
ОТВЕТ
Синтез 4-гидрокси-2-метилиндола (Е) по Фишеру. Синтез Фишера представляет собой конденсацию арилгидразинов с кетонами, последующую циклизацию полученного гидразона в кислых условиях (CH3COOH или ZnCl2) с образованием соответствующего индола. Первой стадией является равновесие между гидразоном A и гидразином В. Следующая стадия, которая необратима, – синхронная электроциклическая реакция, генерирующая прочную углерод–углеродную связь. Полученный имин С немедленно снова ароматизуется таутомеризацией в анилин D. Наконец, катализируемое кислотой элиминирование аммиака дает индол (Е) (эта стадия напоминает последнюю стадию синтеза пиррола по Кнорру).
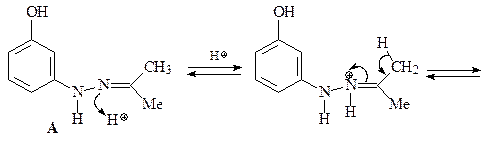
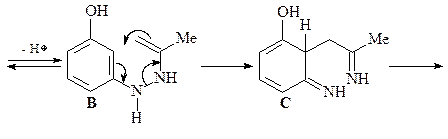
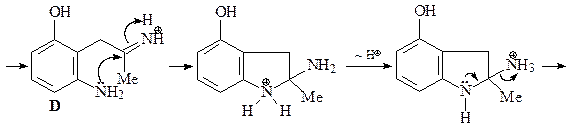
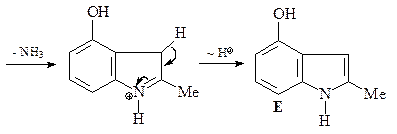
45. Имея в своем распоряжении 3-ацетилпиридин и пара -анизидин (пара -метоксианилин) получите соединение А.
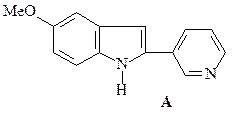
ОТВЕТ
Синтез индолов по Фишеру.
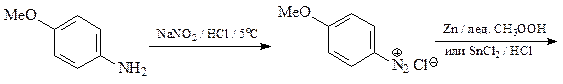
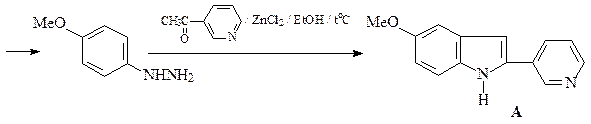
46. Приведите структуру продукта сульфирования индола (А) и механизм его образования.
ОТВЕТ
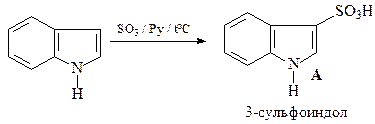
Будучи нуклеофильным гетероциклом, индол легко вступает в реакции электрофильного замещения. Однако в отличие от пиррола, реагирующего преимущественно в положения С-2(С-5), индол дает продукты электрофильного замещения по С-3. Одним из объяснений является то, что атака по С-2 приводит к нарушению ароматичности бензольного кольца.
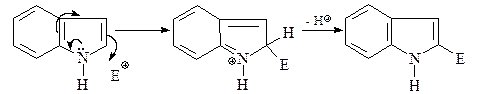
Образующийся же при атаке по С-3 катион стабилизируется без участия бензольного кольца молекулы и более стабилен, чем катион, который генерируется при атаке по С-2.
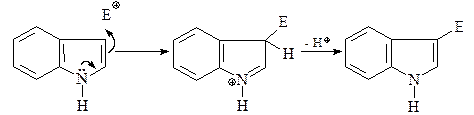
47. Исходя из фенилгидразина и любых других необходимых реагентов, получите 2- и 3-индолкарбоновые кислоты.
ОТВЕТ
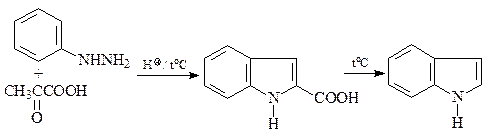
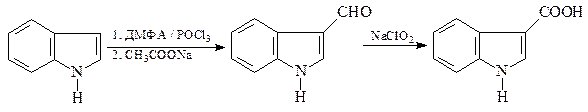
48. Синтезируйте, исходя из ацетофенона, п -анизидина (п -метоксианилина) и других необходимых реагентов, 5-метокси-2-фенилиндол (А).
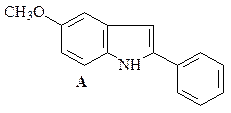
Какой продукт получится в результате обработки индола А Me2NCHO/POCl3 и последующего гидролиза реакционной смеси водным ацетатом натрия?
ОТВЕТ
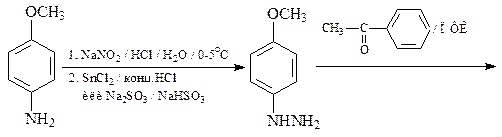
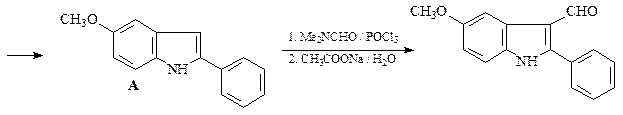
49. Какие продукты образуются в результате каждой из приведенных ниже реакций?
1. 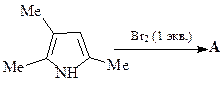 | 2. 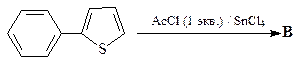 |
3. 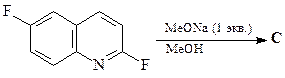 | 4. 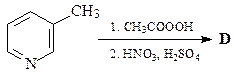 |
5. 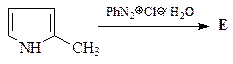 | 6. 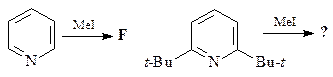 |
ОТВЕТ
1. 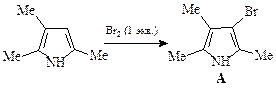 | 2. 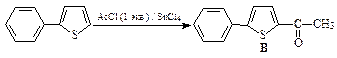 | |
3. 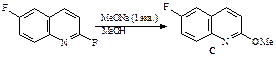 | 4. 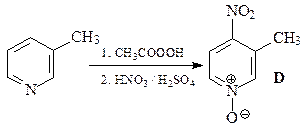 | |
5. 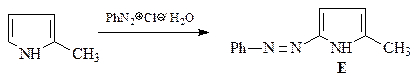 | ||
6. 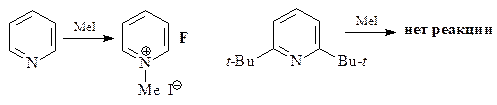 | ||
 2015-08-21
2015-08-21 7217
7217






