| Катион | lg K | Катион | lg K |
| Ag+ | 7,31 | Mg2+ | 9,12 |
| Al3+ | 16,5 | Mn2+ | 14,04 |
| Ва2+ | 7,78 | Na+ | 1,79 |
| Са2+ | 10,59 | Ni2+ | 18,62 |
| Сd2+ | 16,46 | Рb2+ | 18,04 |
| Сe3+ | 15,81 | Pd3+ | 18,5 |
| Со2+ | 16,31 | Sc3+ | 23,0 |
| Сo3+ | 40,6 | Sr2+ | 8,80 |
| Сr3+ | 23,40 | Th4+ | 25,3 |
| Сu2+ | 18,80 | Ti3+ | 21,3 |
| Fe2+ | 14,20 | TiO2+ | 17,5 |
| Fe3+ | 24,23 | Т13+ | 37,8 |
| Ga3+ | 20,5 | V2+ | 12,70 |
| Hg2+ | 21,8 | V3+ | 25,9 |
| In3+ | 25,3 | VO2+ | 18,0 |
| La3+ | 15,5 | Zn2+ | 16,26 |
Таблица 20. Молярные доли этилендиаминтетраацетат-ионов (Y4–) при различных значениях рН раствора
Расчёт кривых комплексонометрического титрования при рН < 10 всегда проводится с использованием условных констант образования комплексонатов металлов при определённом значении рН (К’), поскольку в этом случае протекает побочная реакция протонирования лиганда Y4–.
Для расчёта условных констант необходимы данные о молярной доле Y4– при конкретном значении рН (α), которые приведены в этой таблице.
Кроме того, α позволяет вычислить коэффициент побочной реакции лиганда (k), по величине которого рассчитывается условная константа.
При решении этих задач используются следующие условия и количественные критерии:
|
|
|
| Ø Молярная доля этилендиаминтетраацетат-иона в растворе при конкретном значении рН равна отношению равновесной концентрации [Y4–] к общей концентрации СY: a = [Y4–] / СY. Ø Если побочная реакция протонирования иона Y4– не протекает, то a = 1, а если протекает, то a < 1. Ø Термодинамическая (К0) и условная (К’) константы устойчивости комплексоната связаны соотношением К 0 = К’ / a или К’ = К0 · a. Ø Величина 1 / a называется коэффициентом конкурирующей реакции (k): k = 1 / a = СY / [Y4–]. Ø Если побочная реакция протонирования иона Y4– не протекает, то k = 1, а если протекает, то k > 1. Ø Термодинамическая (К0) и условная (К ’) константы устойчивости комплексоната связаны соотношением К0 = К’ · k или К’ = К0 / k. Ø В результате побочной реакции протонирования иона Y4– устойчивость комплексоната при определённых конкретных условиях резко снижается, поэтому К’ < К0. |
l Пример 13. Рассчитать условную константу устойчивости комплексоната Са2+ при рН = 8.
В таблице 19 находим для комплексоната Са2+ значение рК1 = 10,59. Следовательно К0 = 1010,59 = 3,89·1010. Затем в таблице 20 для рН = 8 находим значение молярной доли лиганда – α = 5,4·10–3. Имея эти данные, рассчитываем К ’:
К ’ = К0·α = 3,89·1010 · 5,4·10–3 = 2,1·108.
Таблица 20
Молярные доли Y4– в растворе ЭДТА при различных рН
| рН | 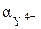
| рН | 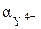
|
| 2,0 | 3,7·10–14 | 8,0 | 5,4·10–3 |
| 3,0 | 2,5·10–11 | 9,0 | 5,2·10–2 |
| 4,0 | 3,6·10–9 | 10,0 | 3,5·10–1 |
| 5,0 | 2,5·10–7 | 11,0 | 8,5·10–1 |
| 6,0 | 2,2·10–5 | 12,0 | 9,8·10–1 |
| 7,0 | 4,8·10–4 |
 2015-09-06
2015-09-06 7177
7177
