Таблица 18. Константы устойчивости комплексных соединений
Константа устойчивости – основная характеристика комплексного соединения, численное значение которой необходимо для решения многих химико-аналитических задач:
1) расчёт равновесных концентраций ионов в растворах комплексных соединений;
2) расчёт сложных равновесий в многокомпонентных растворах:
- расчёт растворимости малорастворимого электролита, если один из ионов одновременно участвует в реакции комплексообразования;
- расчёт окислительно-восстановительного потенциала, если один из компонентов сопряжённой окислительно-восстановительной пары одновременно участвует в реакции комплексообразования;
3) расчёт кривых комплексометрического титрования;
4) выбор маскирующего агента для конкретного иона (см. Пример 11);
5) оценка возможности обнаружения или количественного определения конкретного иона с использованием реакций комплексообразования (см. Пример 12);
6) прогнозирование возможности титрования ионов-комплексообра-зователей или ионов-лигандов (см. Пример 12).
При решении некоторых из этих задач используются следующие условия и количественные критерии:
| Ø Суммарная константа устойчивости равна произведению ступенчатых констант: К = К1·К2·К3·...·Кn–1·Кn или рК = рК1 + рК2 + рК3 +...+ рКn–1 + рКn. Ø В случае ступенчатого комплексообразования скачок на кривой титрования будет наблюдаться, если ступенчатые константы устойчивости различаются не менее чем в 104 раз. |
Очень часто для облегчения расчётов используется не значение самой константы устойчивости К, а её логарифм
р К = – lg К,
который и приведен в таблице.
l Пример 11. Необходимо замаскировать Fe3+ (продукт реакции мешает зафиксировать к. т. т. за счёт собственной окраски) при перманганатометрическом определении Fe2+ в сильнокислой среде.
По данным таблицы выясняем, что Fe3+ образует комплексы со многими лигандами: CN–, Cl–, F–, HPO42–, H2PO4–, OH–, SCN–. Из них:
ü комплексы с ионами Cl– и SCN– являются малоустойчивыми, значит, непригодными для целей маскирования;
ü лиганд CN– очень токсичен;
ü комплексы с ионами OH– не могут существовать в условиях проведения анализа (сильнокислая среда);
ü комплексы с ионами F–, HPO42–, H2PO4– являются очень устойчивыми, кроме того, они неокрашены. Следовательно, эти лиганды можно использовать для маскирования Fe3+, например, добавить в титруемый раствор немного фосфорной кислоты.
l Пример 12. Можно ли провести количественное определение Cu2+, используя реакции комплексообразования с неорганическими лигандами?
Ион Cu2+ – типичный комплексообразователь, образует устойчивые комплексы со многими неорганическими лигандами, например с NH3, OH–, SCN–. Однако комплексометрическое титрование с использованием этих реакций провести невозможно, поскольку разница в ступенчатых константах устойчивости составляет 1–3 порядка, т. е. скачка на кривой титрования не будет.
Таблица 18
Логарифмы суммарных констант устойчивости комплексных
соединений
| Лиганд | Центральный ион | lg Ki при i | |||||
| Br– | Ag+ | 4,38 | 7,34 | 8,00 | 8,73 | 8,44 | – |
| Hg2+ | 9,05 | 17,33 | 19,74 | 21,00 | – | – |
Продолжение табл. 18
| Br– | Pb2+ | 2,23 | 3,00 | 2,83 | 2,93 | – | – |
| CN– | Ag+ | ? | 19,85 | 20,55 | 19,42 | – | – |
| Fe2+ | ? | ? | ? | ? | 18,6 | 36,9 | |
| Fe3+ | ? | ? | ? | ? | ? | 43,9 | |
| Hg2+ | 17,00 | 32,75 | 36,31 | 38,97 | 39,83 | 40,62 | |
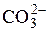
| Ca2+ | 3,2 | – | – | – | – | – |
| Cu2+ | 6,77 | 10,01 | – | – | – | – | |
| Pb2+ | ? | 9,09 | – | – | – | – | |
| Cl– | Ag+ | 3,04 | 5,04 | 5,04 | 5,30 | – | – |
| Bi3+ | 2,43 | 4,7 | 5,0 | 5,6 | 6,1 | 6,42 | |
| Ce3+ | 0,48 | – | – | – | – | – | |
| Cu+ | ? | 5,35 | 5,63 | – | – | – | |
| Fe3+ | 1,45 | 2,10 | 1,10 | 0,85 | – | – | |
| Hg2+ | 6,74 | 13,22 | 14,17 | 15,22 | – | – | |
| Tl3+ | 7,72 | 13,48 | 16,48 | 18,29 | – | – | |
| Pt2+ | ? | 11,48 | 14,48 | 16,00 | – | – | |
| F– | Al3+ | 7,10 | 11,98 | 15,83 | 18,53 | 20,20 | 20,67 |
| Fe3+ | 6,04 | 10,74 | 13,74 | 15,74 | 16,10 | 16,10 | |
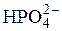
| Fe2+ | 7,2 | – | – | – | – | – |
| Fe3+ | 9,75 | – | – | – | – | – | |
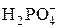
| Fe3+ | 3,5 | ? | ? | 9,15 | – | – |
| I– | Ag+ | 6,58 | 11,74 | 13,68 | 13,10 | – | – |
| Hg2+ | 12,87 | 23,82 | 27,60 | 29,83 | – | – | |
| Pb2+ | 1,26 | 2,80 | 3,42 | 3,92 | – | – | |
| NH3 | Ag+ | 3,32 | 7,23 | – | – | – | – |
| Cu2+ | 3,99 | 7,33 | 10,06 | 12,03 | 11,43 | 8,9 | |
| Hg2+ | 8,8 | 17,5 | 18,5 | 19,3 | – | – | |
| Ni2+ | 2,67 | 4,79 | 6,40 | 7,47 | 8,10 | 8,01 | |
| ОН– | Ag+ | 2,30 | 4,0 | 5,2 | – | – | – |
Окончание табл. 18
| ОН– | Al3+ | 9,0 | ? | – | – | ||
| Bi3+ | 12,4 | 15,8 | ? | 35,2 | – | – | |
| Ca2+ | 1,46 | 11,0 | – | – | |||
| Ce3+ | 4,6 | – | – | – | – | – | |
| Ce4+ | 13,28 | 27,06 | – | – | – | – | |
| Cr3+ | 10,1 | 17,8 | – | 29,9 | – | – | |
| Cu2+ | 6,0 | 13,18 | 14,42 | 14,56 | – | – | |
| Fe2+ | 5,56 | 9,77 | 9,67 | 8,56 | – | – | |
| Fe3+ | 11,87 | 21,17 | 30,67 | – | – | – | |
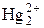
| 9,0 | – | – | – | – | – | |
| Hg2+ | 10,30 | 21,70 | 21,20 | – | – | – | |
| Ni2+ | 4,97 | 8,55 | 11,33 | – | – | – | |
| Pb2+ | 7,52 | 10,54 | 13,95 | – | – | – | |
| Sn2+ | 11,93 | 20,94 | 25,40 | – | – | – | |
| Sn4+ | ? | ? | ? | ? | ? | 63,0 | |
| Tl+ | 0,82 | – | – | – | – | – | |
| Tl3+ | 12,86 | 25,37 | – | – | – | – | |
| SCN– | Ag+ | 4,75 | 8,23 | 9,45 | 9,67 | – | – |
| Al3+ | 0,42 | – | – | – | – | – | |
| Cu+ | ? | ? | 9,90 | 10,05 | 9,59 | 9,27 | |
| Cu2+ | 2,30 | 3,65 | 5,19 | 6,62 | – | – | |
| Fe2+ | 1,31 | 0,43 | – | – | – | – | |
| Fe3+ | 3,03 | 4,33 | 4,63 | 4,53 | 4,23 | 3,23 | |
| Hg2+ | – | 17,60 | 20,40 | 21,20 | – | – | |
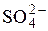
| Al3+ | 3,2 | 5,1 | – | – | – | – |
| Fe2+ | 2,30 | – | – | – | – | – | |
| Fe3+ | 4,04 | 5,38 | – | – | – | – | |
| Pb2+ | 2,62 | 3,47 | – | – | – | – |
Таблица 19. Константы устойчивости комплексонатов металлов
Данные этой таблицы используются аналогично данным табл. 18 применительно к конкретному лиганду – этилендиаминтетраацетату (Y4–). Кроме того, они необходимы для расчёта индикаторной погрешности комплексонометрического титрования.
Таблица 19
 2015-09-06
2015-09-06 2085
2085








