Діаскопія. Метод дає можливість визначити характер еритеми й уточнити деталі елементів ураження. Обстеження полягає у натискуванні скляною пластинкою на елементи ураження. При цьому поблідніння плям червоного кольору свідчить про їх запальний характер, геморагічні плями при діаскопії забарвлення не змінюють і не зникають. Жовтавий відтінок плям засвідчує існування ексудації; наявність горбків, що маскуються еритемою (у хворих на туберкульоз), при діаскопії проявляється специфічною картиною «яблучного желе».
Проба Шіллера—Писарєва виявляє ступінь запального процесу. Її застосовують для контролю ефективності протизапальної терапії, а також ступеня зроговіння епітелію. Проба грунтується на властивості вітального забарвлювання глікогену в клітинах епітелію.
Методика. На обстежувану поверхню CO на 1 хв накладають тампон, змочений розчином Люголя (розчин йоду у водному розчині калію йодиду). Здорова CO має солом'яно-жовтий колір (негативна проба), за наявності запального процесу — світло-коричневий (слаб-копозитивна проба) або темно-бурий (позитивна проба).
Стоматоскопія — візуальне обстеження ураженої CO за допомогою спеціального приладу — фотодіаскопа люмінесцентного, який збільшує обстежувану зону у 20—30 разів. При огляді можна використовувати вітальні барвники (розчин Люголя, гематоксилін чи толуїдиновий синій), у такому разі цей метод називають розширеною стоматоскопією.
Методи вітального забарвлювання грунтуються на властивості клітин інтенсивно сприймати барвники. Для цього розчин барвника на 2—3 хв наносять на СОПР. Так, при використанні гематоксиліну атиповий епітелій забарвлюється в темно-фіолетовий, а нормальний — у блідо-фіолетовий колір. Більша
інтенсивність забарвлення клітин при раку пояснюється збільшеною кількістю ядерної субстанції й гіперхромністю ядер. При зроговінні ці зони СОПР бідні на клітини, що мають ядра;
при цьому виявляється ефект негативності забарвлювання (клітини не забарвлюються).
Методика використання толуїдинового синього ідентична методиці застосування гематоксиліну. Різниця є лише у відтінку забарвлення: атиповий епітелій забарвлюється у темно-синій колір, нормальний — у блідо-синій. До речі, забарвлювання толуїдиновим синім дає чіткішу картину, ніж забарвлювання гематоксиліном.
Стоматоскопія дає змогу конкретизувати клінічний діагноз ще у ранніх стадіях розвитку патологічного процесу, тому доцільно проводити її за наявності навіть незначних змін епітелію СОПР.
У процесі стоматоскопі'!' можливо документувати осередки ураження CO за допомогою фотодіаскопа, фіксуючи їх на фотоплівці (фотостоматоскопія). Використовуючи фотодіаскоп або спеціальний прилад ОЛД-14, можна провести люмінесцентне дослідження (ЛД), яке грунтується на властивості тканин та їх клітинних елементів під дією ультрафіолетових променів (промені Вуда) змінювати свій колір — флуоресціювати. Флуоресценція власних речовин тканини називається первинною. Вторинна флуоресценція виникає під дією флуоресціюючих речовин (флуоресцеїн, флуорохром, еозин, рибофлавін, тетрациклін та ін.).
ЛД дозволяє одержати докладнішу інформацію про зону ураження CO і допомагає в діагностиці, особливо при захворюваннях, що супроводжуються зроговінням епітелію. Здорова CO відсвічує блідо-синювато-фіолетовим кольором, кератоз дає середньої інтенсивності свічення з тьмяним жовтим відтінком, гіперкератоз — з голубувато-фіолетовим; запалення CO — інтенсивне синюшно-фіолетове забарвлення. Ерозії та виразки проявляються темно-коричневими або чорними плямами, що пояснюється відсутністю у крові флуоресцентних властивостей. Плями червоного вовчака, навіть погано помітні візуально, характеризуються білосніжно-голубуватим чи сніжно-білим свіченням. Дно ракової виразки дає коричнево-оранжеве свічення;
туберкульозні та сифілітичні виразки — темно-фіолетове. Зони застійної гіперемії червоної кайми губ набувають темно-фіолетового відтінку, серозно-кров'янисті кірочки — жовтаво-коричневого.
Визначення електричних потенціалів у порожнині рота. Сим-птомокомплексом, який розвивається при контакті м'яких тканин CO із стоматологічними металами та їх включеннями в умовах зсуву рН ротової порожнини у кислий бік, спричинюється виникнення гальванічного струму, що надалі зумовлює алергізацію тканин, місцеву подразливу дію. Якщо у порожнині
?* 35
рота є різнойменні метали, то в ній виникають електричні потенціали, які бувають позитивні й негативні. Щоб їх виявити. вимірюють величину мікрострумів між металевими парами або між металевими включеннями і здоровими ділянками CO. Для цього платинові електроди мікрогальванометра прикладають почергово до деталей протезів з різних металів. При цьому необхідно визначити рН слини (електроліт) з допомогою рН-метра або спеціальних лакмусових папірців, оскільки зсувом рН у кислий бік підтримується виникнення гальванічних струмів. Величина електропотенціалів у ротовій порожнині, де немає металевих включень, дорівнює 2—5 мкВ; за наявності золота — +20... +50 мкВ; нержавіючої сталі — —20... —120 мкВ; золота-сталі—амальгами — 500 мкВ.
Лабораторні методи обстеження
| Таблиця Ї. Показники гемограми периферичної крові |
| Показники | Значення в одиницях СІ |
| Еритроцити | |
| у жінок | 3,8-4,5 Ю'Ул |
| у чоловіків | 4,5-5,0 Ю'Ул |
| Гемоглобін | |
| у жінок | 120—140 г/л |
| у чоловіків | 130—160 г/л |
| Кольоровий показник | 0.9-1,1 |
| Лейкоцити | 4,0-9,0 ІО'/л |
| паличкоядерні | 1-6 % |
| сегментоядерні | 47—72 % (66 %) |
| Еозинофіли | 0,5-5 % |
| Базофіли | 0-1 % |
| Моноцити | 4-10% |
| Лімфоцити | 19-37 % |
| ШОЕ | 2—10 мм/год |
| Ретикулоцити | 0.8-1,0 % |
| Тромбоцити | 200,0-300,0 Ю'/л |
| Час зсідання крові: початок — 1 хв 35 с — 2 хв, закінчення — 2 хв 50 с — 4 хв. Час кровотечі — 3 хв |
Постановка діагнозу здебільшого відбувається у кілька етапів. Під час опитування хворого лікар складає певне уявлення про характер захворювання, при огляді — конкретизує свої припущення. Надалі може виникнути необхідність у залученні допоміжних лабораторно-інструментальних методів дослідження, роль яких — підтвердити або спростувати вірогідність попереднього діагнозу. При цьому вони набувають вирішального значення у розпізнаванні захворювання.
Залежно від характеру ураження CO застосовують загал ь-ноклінічні (клінічний аналіз крові, сечі) та спеціальні методи дослідження: морфологічні (цитологічне дослідження, біопсія), мікробіологічні (бактеріологічне дослідження, бактеріоскопія), гісто-, цитохімічні, імунологічні, серологічні, функціональні та інші методи.
Загальне клінічне дослідження крові є важливим допоміжним методом обстеження, якого потребує кожен хворий з патологією СОПР (табл.1).
Безумовно необхідно досліджувати кров хворих з виразково-некротичними ураженнями СОПР та проявами геморагічного діатезу, а також при
підозрі на захворювання крові. Аналіз крові дає змогу уточнити характер захворювання СОПР, виявити його можливий зв'язок з патологією органів кровотворення. Так, при деяких захворюваннях запального характеру з гострим перебігом кількість лейкоцитів, а також відсоток нейтрофільних гранулоцитів, лімфоцитів вищі від норми, значно зменшена кількість моноцитів та еозинофілів (ацидофільних гранулоцитів); швидкість осідання еритроцитів (ШОЕ) збільшена. У разі розвитку деяких хронічних захворювань та інтоксикації гемограма може мало змінюватися або, навпаки, характеризуватися значним зменшенням кількості еритроцитів, зниженням вмісту гемоглобіну, зміщенням лейкоцитарної формули вліво, збільшенням ШОЕ. Неспецифічними тестами алергізації організму є такі: еозино- філія, тромбопенія, лейкопенія, лімфоцитоз. Значне зменшення кількості еритроцитів, зміна їх форми, зниження рівня гемоглобіну в них є типовими ознаками анемії.
Так званий патологічний лейкоцитоз як захисна реакція має місце при запальних процесах та виразково-некротичних ураженнях СОПР, різних проявах алергії тощо.
Лейкопенія може спостерігатися і у здорових людей (короткочасно після перегрівання, тяжкої фізичної праці), проте насамперед її слід розцінювати як ознаку серйозних порушень в організмі.
Лімфоцити відіфають велику роль у виробленні імунітету. Вони фіксують токсини і беруть участь в утворенні антитіл (можуть перетворюватися на так звані плазматичні клітини, які виробляють у-глобулін). Виявивши ті або інші зміни лімфоцитів, лікар не тільки може вірно оцінити розвиток захворювання, а й виробити тактику лікування.
Еозинофілія розвивається при підвищенні рівня гістаміну в крові й має місце при алергізації організму, імунних та автоімунних захворюваннях, глистяній інвазії, гістіоцитозі Х тощо.
Тромбоцити відіграють важливу роль у спиненні кровотечі. В разі руйнування їх унаслідок підвищеної чутливості до деяких лікарських препаратів, при отруєннях певними хімічними сполуками тощо може розвинутися тромбоцитопенія. Проте не слід забувати про можливість фізіологічної тромбоцитопенії (під час сну, в період менструації). Визначення стану тромбоцитів при деяких захворюваннях буває вирішальним у діагностиці, особливо це стосується геморагічних синдромів.
Біохімічне дослідження крові здійснюють з метою визначення протеїн о грами, концентрації протеїнів, електролітів у сироватці крові, вмісту вітамінів та ін.
Білки крові. Концентрація протеїнів у плазмі крові має важливе діагностичне значення, оскільки за цим показником можна робити висновок про ступінь тяжкості захворювання. Так, якщо в нормі кількість білка в сироватці крові людини
становить 5—7,5 г/100 мл, то, наприклад, при пухирчатці вона знижується до 4,9 і навіть до 3,6 г/100 мл сироватки.
Протеїнограма дає змогу оцінити стан реактивності організму й зробити прогностичні висновки. Протеїнограму периферичної крові одержують за допомогою електрофорезу на гелі або папері (табл. 2).
Таблиця 2. Показники альбумінів і глобулінів у здорових людей
| Альбуміни, Ж | Глобуліни, % | |||
| ttl | Ct2 | P | Y | |
| 61.2 ± 1,2 | 4,2 ± 0,36 | 9,2 ± 0,51 | 14,1 ± 1,4 | 15,1 ± 1,02 |
Підвищений рівень Р- і у-глобулінів є неспецифічним тестом діагностики алергічних станів.
Під час загострення запального процесу в СОПР кількість a,-, a;- і у-глобулінів зростає, а відсоток альбумінів помітно зменшується. При хронічних захворюваннях СОПР рівень альбумінів знижується незначно, кількість глобулінів збільшується за рахунок фракцій сії та у; фракції а; і р змінюються мало.
У клініці інколи виникає потреба у визначенні вмісту фібриногену. У хворих із запальними захворюваннями кількість фібриногену в плазмі крові збільшується і може досягати 58 мг/100 мл плазми крові при 29 мг/100 мл у здорових осіб.
При захворюваннях, що спричинюються порушенням вітамінного балансу, використовують методи визначення вмісту вітамінів у крові з метою остаточного з'ясування характеру гіповітамінозу, а також для контролю за ефективністю вітамінотерапії. В нормі у крові міститься 60—70 мг% вітаміну А, 0,9—1 мг% вітаміну С, 0,6—0,9 мг% вітаміну Е, 0,5 Мг% вітаміну К.
Пробу Роттера і «язикову» пробу застосовують для виявлення насиченості організму вітаміном С. При постановці проби Роттера 0,1 мл 0,0025 N свіжого розчину барвника Тільманса вводять внутрішньошкірно на внутрішньому боці передпліччя, час знебарвлення розчину в разі достатньої насиченості організму вітаміном С не перевищує 10 хв. Язикова проба: на висушену поверхню спинки язика ін'єкційною голкою (діаметр 0,2 мм) із шприца наносять одну краплину індикатора — 0,06 % розчину натрієвої солі 2,6-дихлорфеноліндофенолу (барвник Тільманса), що відновлюється аскорбіновою кислотою при кімнатній температурі, знебарвлюючи при цьому індикатор. Час знебарвлення розчину, більший ніж 16—20 с, свідчить про дефіцит аскорбінової кислоти.
Визначення електролітів крові. У здорових людей концентрація натрію в сироватці крові становить 140 мекв/л, хлоридів — 120 мекв/л, кальцію — 5 мекв/л, калію — 4,5 мекв/л. Ступінь змін концентрації електролітів часто корелює з тяжкістю захворювання. Особливе діагностичне й прогностичне
значення ці показники мають при пухирчатці, коли кількість натрію, хлоридів, кальцію зменшується, а рівень калію може збільшуватися до 10—12,7 мекв/л.
Моноцитограма — тест, за яким можна визначити функціональний стан мезенхіми (метод диференційованого підрахунку різних форм моноцитів периферичної крові та визначення їх відсоткового співвідношення. У нормі відсоткове співвідношення різних груп диференційованих моноцитів таке:
промоноцити — 20—28 %, власне моноцити — 26—32 %, по-ліморфноядерні моноцити — 42—52 %. Зміна його у бік зростання рівня поліморфноядерних клітин свідчить про зниження захисної реакції організму.
Дослідження сечі проводять при запальних процесах CO та патології пародонта (з метою виявлення захворювання нирок), а також для визначення рівня глюкози в сечі й своєчасної діагностики цукрового діабету (в разі сухості в порожнині рота).
Цитологічні дослідження є різновидом морфологічного методу. За їх допомогою вивчають клітинний склад елементів ураження CO при різних її патологічних станах. Простота одержання і доступність матеріалу, можливість без обмежень повторювати дослідження дають підставу застосовувати цитологічні дослідження як діагностичні з метою виявлення етіологічного чинника захворювання, а також для об'єктивної оцінки реактивності організму хворого, перебігу хвороби в jw- наміці й ефективності проведеного лікування. Методи клінічної цитологічної діагностики добре зарекомендували себе в стоматології при розпізнаванні онкологічних захворювань, виразково-некротичного стоматиту, пухирчатки, простого герпесу тощо.
Цитологічні препарати готують методом вщбитка або пере-відбитка (коли елементи ураження CO знаходяться в місцях, недоступних до одержання прямого відбитка) виразкової поверхні. Якщо одержати відбиток чи мазок неможливо, то препарат отримують із осаду ротової рідини.
При вивченні препаратів виявляють такі клітинні елементи' клітини гематогенного походження — нейтрофільні гранулоцити, еозинофіли (ацидофільні гранулоцити), лімфоцити та ін;
клітини гістогенного походження — фібробласти, гістіоцити (осілі макрофаги), плазмоцити тощо; клітини епітелію — зроговілі, схильні до зроговіння, атипові, акантолітичні (клітини Тцанка); специфічні клітини — типу Лангганса, епітеліоїдні, «монструозні», клітини герпесу. Крім того, визначають мікроорганізми — коки, веретеноподібні бактерії, спірохети, гриби. Оцінка клітинного складу ексудату дає змогу скласти уявлення про захисні реакції CO. При цьому визначають якісне й кількісне співвщношення нейтрофільних гранулоцитів, активність фагоцитозу. Важливою для діагностики є кількість наявних у препаратах лімфоцитів, вільних макрофагів, епітеліальних та плазматичних клітин.
Як додатковий тест можна використати флуоресцентну цитодіагностику. З цією метою цитологічний препарат обробляють флуоресцентними барвниками і досліджують під флуоресцентним мікроскопом. При цьому у клітинах здорових зон CO цитоплазма флуоресціює зеленими (темно-зеленими) відтінками, її ядро — світло-зеленим кольором з переходом до жовтавого.
Індекс кератинізації (ІК) виявляє ступінь кератинізації (зроговіння) та характеризує бар'єрну функцію CO. Для одержання ІК обчислюють загальну кількість епітеліальних клітин у полі зору мікроскопа, потім кількість виявлених зроговілих клітин множать на 100 і ділять на їх загальне число. Зниження ІК у процесі динамічного обстеження свідчить про спад захисної функції CO.
Мікробіологічне дослідження дає змогу уточнити причину захворювання, виявити вид інфекції, встановити її вірулентність і чутливість до антибіотиків та інших протимікробних препаратів
При мікробіологічному дослідженні необхідно дотримуватись певних правил. До взяття матеріалу не можна вживати жодних лікарських засобів, полоскати рот або чистити зуби. Безпосередньо перед взяттям матеріалу слід промити рот теплою водою, очистити поверхню виразки стерильним марлевим тампоном, після чого взяти матеріал з глибини виразки і терміново направити в лабораторію. Матеріал беруть стерильними щільно згорнутими з вати кульками діаметром 2—5 мм або мікробіологічною петлею. Висівають його на спеціальні живильні середовища в пробірки або на чашки Петрі.
Бактеріоскопічне дослідження матеріалу (виявлення мікроорганізмів), одержаного з поверхні виразок, ерозій та інших елементів ураження СОПР, здійснюють з метою виявлення збудників деяких захворювань і специфічних інфекцій (туберкульоз, сифіліс, гонорея, актиномікоз, кандидоз, лепра). У лабораторній практиці проводять мікроскопію як нативних (свіжих, необроблених), так і фіксованих препаратів. Останню часто застосовують для діагностики патології, зумовленої дріжджеподібним грибом роду Candida. Матеріал для дослідження (білі бляшки та сирнистий наліт) беруть прожареною й охолодженою платиновою петлею або стерильним зуболікарським шпателем уранці, обов'язково до приймання їжі та чищення зубів. Поодинокі дріжджові клітини в препараті, навіть у стадії брунькування, не мають діагностичного значення, оскільки як сапрофіт гриб роду Candida трапляється у 60 % здорових людей Про патологію свідчать виявлення значної кількості елементів гриба і значне його брунькування, наявність міцелію або псевдоміцелію.
Виявлення блідої тре по не ми (мікроскопія в темному полі) у матеріалі первинної сифіломи або в пунктаті лімфатичного вузла при первинному сифілісі та в папулах і ерозіях — при вторинному слугує цілковитим підтвердженням діагнозу.
При виразково-некротичному стоматиті та ангіні Венсана в 100 % випадків виявляють симбіоз веретеноподібної палички та спірохети Венсана. Значно складніше при бактеріоскопічному дослідженні виявити паличку Коха.
Алергологічні методи обстеження застосовують при підозрі на алергічне ураження СОПР.
В алергологічному анамнезі звертають увагу на обтяжену алергічними захворюваннями спадковість, схильність хворого до алергії в минулому і в даний час, уточнюють можливу причину алергічної реакції та реальний алерген. З цією метою виявляють супутні захворювання, реакцію організму хворого на продукти харчування, рослини, запахи, лікарські засоби, побутові та промислові хімічні речовини тощо.
Алергологічне обстеження проводять за допомогою специфічних та неспецифічних алергологічних тестів.
Неспецифічні алергологічні тести. До них відносять еозинофілію і лейкопенію секрету в зоні запалення та периферичної крові, тромбоцитопенію і лейкопенію до агранулоцитозу; підвищення вмісту глобулінів, особливо фракції у, у сироватці крові. Вірогідність цих тестів досягає ЗО—40 %.
Специфічні алергологічні тести дозволяють виявити сенсибілізацію організму до певного алергену. До них належать шкірна та мукозна проби; клітинні тести — реакція леикоцитолізу, показник порушення нейтрофілів (ППН); реакція агломерації лейкоцитів (РАЛ), індекс тромбоцитів, реакція дегрануляції базофілів (базофільний тест, або тест Шеллі) та ін.
Серед шкірних проб розрізняють аплікаційну, краплинну, скарифікаційну та внутрішньошкірну проби, які застосовують з метою запобігання інтенсивним загальним реакціям анафілактичного характеру.
Аплікаційна проба. На оброблену спиртом чи спирто- ефіром внутрішню поверхню шкіри передпліччя накладають марлю, яка складена в декілька шарів у формі квадрата розміром 1 х 1 або 1,5 х 1,5 см і змочена розчином або екстрактом однієї чи кількох досліджуваних речовин. Марлевий згорток закривають целофаном або компресним папером і фіксують лейкопластирем. Результати проби знімають через 10—20 хв (при реакції негайної дії) та через 24—48 год (при реакції уповільненої дії) За наявності гіперемії, гіперемії" та інфільтрації, набряку й гіперемії, пухирів реакцію вважають позитивною. Надмірно позитивна реакція може супроводжуватися набряком, гіперемією, утворенням великого пухиря чи некрозом всієї поверхні дотикання алергену до шкіри.
Краплинна проба. На здорову поверхню шкіри наносять 1—2 краплини розчину досліджуваної речовини в спирті або ізотонічному розчині натрію хлориду і дають йому висохнути. Результати краплинної проби оцінюють через 2, 4, 12 і 24 год.
Скарифікаційна проба. Розчин тест-препарату наносять на скарифіковану шкіру або роблять скарифікацію крізь краплину цього розчину, нанесеного на поверхню шкіри передпліччя. Реакція негайної дії проявляється через 1—20 хв і супроводжується свербінням, почервонінням, набряком; інколи виникає пухир, а при гіперчутливості елементи кропив'янки можуть з'явитися і на віддалених ділянках шкіри. З огляду на це у дуже чутливих пацієнтів скарифікаційну пробу проводять лише за наявності негативних результатів краплинної та аплікаційної проб.
Об'єктивним тестом установлення алергії до металів є скарифікаційно-плівковий (Ю.П.Бородін, 1976). На внутрішню поверхню передпліччя наносять по 1 краплині спиртових розчинів таких солей: 0,5 % К;,Сг:,От, 5 % NiCL;, 5 % СО(МОз);. Після цього на глибину епідермісу роблять по дві паралельні подряпини завдовжки 10 мм на відстані 3—4 мм одна від одної. Коли краплини розчину висохнуть, їх покривають клеєм БФ-6. Оцінку реакції проводять через 24—48 год за 4-бальною системою.
Алергію до металів можна також виявити за результатами аплікаційної проби на СОПР або за допомогою спеціального пристрою для визначення чутливості тканин до досліджуваних матеріалів (а.с. № 1526652). Експрес-діагностику алергії до металів можна провести з використанням явища магнітоядерного резонансу речовин.
Внутрішньошкірна проба. Внутрішньошкірно вводять 0,02—0,05 мл стерильної досліджуваної речовини і на деякій відстані (35—40 мм) — таку саму кількість ізотонічного розчину натрію хлориду. Через 24—48 год визначають реакцію шкіри, порівнюючи її на місці введення досліджуваного розчину з контролем. Внутрішньошкірні проби дуже чутливі, проте їх не можна застосовувати для діагностики алергії" до мономеру пластмаси, компонентів зубних паст, помади та інших матеріалів, які використовують в ортопедичній стоматології та косметиці.
М у козні проби ставлять у випадку високої чутливості СОПР. При цьому алерген вміщують у присоску чи приставку, в глибині якої колодієм приклеюють шматочок матеріалу, насиченого розчином досліджуваної речовини. Присоску прикріплюють до нижньої губи таким чином, щоб ця речовина не мала з губою прямого контакту.
В осіб, що мають зуби, точніший результат отримують у тому разі, коли алерген вміщують на пластинку (але це більш кропітка робота). Спочатку з каучуку або шелаку лабораторним методом виготовляють пластинку з кламерами, за допомогою яких вона тримається на зубах. Після припасування пластинки в порожнині рота на її поверхні, зверненій до піднебіння, роблять дві лунки діаметром 25 мм і глибиною 2 мм. В одну з них вносять подразник, в іншу — ізотонічний розчин натрію хлориду. Пластинку тримають на піднебінні 12—48 год. Протягом
цього часу хворий має утримуватися від споживання рідкої їжі. Оцінка результатів: 1 — гіперемія (+); 2 — гіперемія з набряком (++); 3 — гіперемія з маленькими пухирцями (+++); 4 — зливні елементи (++++); 5 — некроз (+++++).
Клітинні тести. Реакція лейкоцитолізу грунтується на виявленні деформівної дії бактеріальних алергенів на лейкоцити периферичної крові. В пробірку беруть 1 краплину цитрату і З краплини крові пацієнта (в лейкоцитах крові хворих на бактеріальну алергію є «фактор переносу», або «алергізувальний фактор», який спричинює деформацію лейкоцитів при дії на них специфічного алергену), додають 1 краплину алергену, обережно змішують і на 1 год ставлять у термостат при температурі 37 °С. Потім готують 3 тонких мазки крові, які забарвлюють за Паппенгеймом—Крюковим Підраховують по 100 нейтро- фільних гранулоцитів у трьох мазках, виокремлюючи деформовані та зруйновані лейкоцити. Специфічний алерген деформує і руйнує понад 14 % нейтрофільних гранулоцитів, неспецифічна деформація не перевищує 10 %.
Оцінка агломерації лейкоцитів зводиться до окремого підрахунку клітин, що утворюють групи не менш як з трьох лейкоцитів. Відсоток склеювання лейкоцитів є показником ступеня агломерації. Реакцію вважають позитивною, якщо різниця дослідного і контрольного показників не менша від ЗО %.
Реакція базофільних гранулоцитів за Шеллі грунтується на їх властивості виділяти гістамін у відповідь на дію алергену. Лейкоцити у цій реакції використовують як клітини-індикатори. Реакцію застосовують для діагностики медикаментозної алергії та полінозів (алергії до пилку рослин).
Засадою реакції дегрануляції тканинних базофілів сполучної тканини є властивість цих клітин виділяти чи фіксувати із зовнішнього середовища гістамін і концентрувати його в гранулах. При постановці реакції використовують сироватку крові обстежуваного хворого, перитонеальні тканинні базофіли щура, специфічний алерген рослинного чи продуктового походження, який підозрюється як фактор сенсибілізації, а також контрольний неспецифічний алерген.
Тест оцінюють за даними мікроскопії препарату (х 280), в якому проглядають 100 тканинних базофілів, що не контактують один з одним. Серед них виділяють нормальні й дегрануль-овані. Дегрануляція тканинних базофілів проявляється ослабленням забарвлення гранул, віднаходженням у цитоплазмі вакуоль із знебарвленою «короною*», розривом і «виходом» гранул. Клітини, цілком позбавлені забарвлення, мають вигляд медових стільників. Відсоток дегранульованих тканинних базофілів обчислюють, віднявши від кількості цих клітин у досліджуваному препараті найбільше число їх в одному з контрольних препаратів. Тест вважають позитивним, коли відсоток дегранульованих клітин перевищує 10.
Методи оцінки імунологічного стану хворих із ураженням
СОПР. При деяких захворюваннях СОПР виникає потреба у проведенні імунологічного обстеження хворого Існуючі серологічні реакції використовують у разі підозри на специфічну інфекцію (реакції Вассермана, Кана та цитохолеві осадові — для діагностики сифілісу; реакцію Райта — бруцельозу, лепромінову пробу — лепри). Слід враховувати, що при первинному сифілісі серологічні реакції стають позитивними тільки через 2—3 тиж після виникнення твердого шанкеру. В третинному періоді вірогідність серологічних реакцій становить 50—75 % При вторинному сифілісі вони, як правило, позитивні, проте можливе і негативне значення реакції. Ось чому, запідозривши сифіліс, стоматолог повинен залучити до обстеження дермато венеролога Разом з тим необхідно пам'ятати, що реакція Вассермана може бути позитивною при хронюсепсисі, гострих інфекційних захворюваннях, малярії, інфаркті міокарда, раці тощо; слабкопо- зитивною — у вагітних і навіть при запорах
У хворих із ураженням CO неспецифічна резистентність знижена відповідно до тяжкості їхнього стану — спостерігаються пригнічення функціональної активності сполучної тканини, зниження титру лізоциму, фагоцитарної активності лейкоцитів, комплементарної активності сироватки крові, пригнічення активності макрофагів, підвищення ушкодження ней-трофільних гранулоцитів, високі показники РАЛ Неспецифічними тестами алергізації організму є еозинофілія периферичної крові й тканин зони ураження, тромбопенія, лейкопенія, агранулоцитоз, зміни протеїнограми, реакція адсорбції мікроорганізмів
Внутрішньошкірна проба Р.Е.Кавецького в модифікації С.М Базар нової виявляє функціональний стан сполучної тканини. Грунтується на властивості тканини затримувати індиферентні барвники.
В CO нижньої губи вводять 0,1 мл 0,25 % стерильного розчину трипанового чи метиленового синього Про розповсюдження барвника судять за розміром плями, її'діаметр вимірюють у момент введення барвника і через 3 год Величина співвідношення квадрата радіуса плями у момент введення барвника і квадрата радіуса через 3 год є коефіцієнтом проби Кавець- кого В нормі він дорівнює 5—7 Значення нижче від 5 свідчить про пригнічення, а понад 7 — про підвищення реактивності Величини 1—2 є свідченням повної ареактивності організму.
Лізоцим у слині виявляють за методом Лоурі, який грунтується на властивості слини розщеплювати полісахариди клітинної оболонки бактерій. Активність лізоциму визначають за допомогою нефелометричного методу за зміною мутності суспензії Micrococcus lisoideis і виражають у мікрограмах кристалічного лізоциму на 1 мг білка за ЗО хв інкубації при температурі 37 °С. Крім того, визначають його рівень у 1 мл слини.
Фагоцитарна активність лейкоцитів віддзеркалює рівень захисту CO при різних її станах. Для установлення фагоцитарної активності використовують двомільярдну суспензію убитої нагріванням добової культури стафілокока (штам 209). Іі змішують з 0,1 мл цитратної крові хворого. Суміш інкубують у термостаті при температурі 37 °С протягом ЗО хв за 2 год, готують мазки, підраховують для обох експозицій інкубації число клітин, що захопили мікроорганізми, — фагоцитарний індекс (ФІ), а потім встановлюють індекс завершеності фагоцитозу (ІЗФ) за формулою:

Реакція адсорбції мікроорганізмів (РАМ) розроблена і рекомендована нами для оцінки опірності організму при різних захворюваннях як прогнозуючий фактор і як метод оцінки ефективності лікування. Грунтується на оцінці кількості мікроорганізмів, що адсорбовані на поверхні епітеліальних клітин. Методом зскрібання беруть мазок з видимо здорової поверхні CO, забарвлюють за Романовським, Паппенгеймом чи Лейшманом і вивчають співвідношення мікрофлори й клітин епітелію СОПР. У мазках підраховують кількість коків, які адсорбовані на поверхні епітеліальних клітин
Залежно від кількості мікроорганізмів, адсорбованих на поверхні клітин епітелію, їх поділяють на 4 групи: І — епітеліальні клітини, що не мають на своїй поверхні адсорбованих мікроорганізмів або мають лише поодинокі коки; П — адсорбція 5—25 коків; III — адсорбція 26—50 коків; IV — адсорбція 51 кока і більше на поверхні епітеліальної клітини (тип «мурашника»).
Розрахунок проводять на 100 епітеліальних клітинах І і II групи — негативна РАМ, III і IV — позитивна. При мікроскопії в кожному мазку визначають відсоток клітин з позитивною та негативною РАМ За відсотком позитивної РАМ визначають опірність організму: 70 % позитивної РАМ і вище — функціональний стан організму добрий, 31—69 % — задовільний, ЗО % і нижче — незадовільний.
Досить поширеним методом діагностики захворювань СОПР є гістологічне дослідження.
Біопсія — прижиттєве взяття тканин для мікроскопічного (гістологічного) дослідження. Біопсію головним чином проводять у складних випадках диференціальної діагностики захворювань СОПР (новоутворення, передракові захворювання СОПР, виразки, шо тривало не загоюються) При цьому, дотримуючись правил асептики й антисептики, під інфільтраційною чи провідниковою анестезією тканин ножицями, скальпелем чи спеціальним інструментом (голки різних конструкцій при пункційній біопсії та трепанодиссектори при дослідженні кісткової, хрящової та фіброзної тканини) видаляють найхарак-
тернішу частку ураження СОПР (шматочок тканини розміром 3—5 мм3 з підслизовою основою та підлеглими тканинами) з частиною здорової CO. Рану зашивають. Біопсійний матеріал вносять у пробірку з фіксуючим розчином (найчастіше — 10 % нейтральним формаліном) і направляють у патогістологічну лабораторію для дослідження. При цьому обов'язково зазначають дату проведення біопсії, паспортні й анамнестичні дані пацієнта, результати об'єктивного обстеження та попередній діагноз.
Флуоресцентна біомікроскопія. Застосовують для діагностики передпухлинних захворювань та раку СОПР і губ.
Оскільки ознаки початку малігнізації практично невловимі, то необхідні додаткові методи дослідження, які передують біопсії. Особливо цінними є методи прижиттєвого мікроскопічного дослідження. Так, метод біомікроскопії із застосуванням толуїдинового синього використовують для діагностики онкологічних захворювань СОПР та червоної кайми губ. Ще чутливішою з точки зору клінічної діагностики є люмінесцентна методика прижиттєвого дослідження органів і тканин — контактна флуоресцентна біомікроскопія (КФБ) (Е.М.Брумберг, І.Я.Барський, 1978).
Для КФБ використовують пристрій, який зібраний з переоснащеної системи мікроскопа МБІ-1, люмінесцентного світильника 01-28, комплекту для контактної біомікроскопії ОЛК-2 та підставки для підборіддя. Використовуючи контактний об'єктив ЛК 25 х 0,75 з різними окулярами, одержують збільшення об'єкта в 120—240 разів. Для цього досліджувану ділянку обробляють розчином акрид й нового оранжевого 1:1000 (цей флуорохром дає жовто-зелене світіння з ДНК і оранжеве — з РНК) і розглядають її в полі зору мікроскопа. Глибина проглядання тканин — 32—40 мкм. Для дослідження поверхні із зроговінням її додатково обробляють нефлуоресціюючою олією, що підвищує прозорість рогового шару і дає можливість судити про зміни у глибині тканин.
У нормі на червоній каймі губ при КФБ виявляють неоднорідне зеленувате світіння поверхневого шару без'ядерних зроговілих клітин без чітких меж між ними. На CO добре виділяються круглі клітинні ядра, що світяться жовто-зеленим на фоні зеленуватої цитоплазми. В ядрах видно хроматин. Розташування ядер в одному шарі однорідне. Форма їх кругла, розміщені вони на деякій відстані одне від іншого, межі клітин видно нечітко.
Дослідження функції слинних залоз проводять у нормі, а також при гіпо- чи гіперплазії, ксеростомії. Склад слини дуже різноманітний і лабільний. При захворюваннях фізичні, хімічні та біохімічні показники її мають дуже велике діагностичне і прогностичне значення (табл. 3). Під час дослідження визначають швидкість і кількість виділення слини, головним чином натще або після пробного сніданку. Слину збирають у мірну про-
бірку. Якщо кількість слини менша за ЗО мл/год (0,5 мл/хв) натще і 50 мл/год (0,8 мл/хв) після пробного сніданку, то швидкість секреції вважають зменшеною. Для стимуляції слиновиділення застосовують 1 % розчин пілокарпіну (8 краплин усередину), лимонну кислоту (кристалик під язик), 1 см- парафіну (для жування). Про функцію малих слинних залоз судять за кількістю цих залоз, що функціонують на поверхні CO площею 4 см2 (у нормі їх близько 20). Секреторну функцію цих залоз визначають за кількістю виділеного секрету, що всмоктується з цієї поверхні промокальним папером. Кількість секрету, що виділяється однією залозою, дорівнює (1,85±0,7) • Ю^/хв. Її визначають за формулою:
а (маса папірця, насиченого секретом) — b (маса папірця до насичення) Р п (кількість функціонуючих залоз)
Таблиця 3. Кількісний і якісний склад змішаної слини
| Показник | Середнє значення | Показник | Середнє значення |
| Кількість слини | 1400—1500 мл/добу | Загальний азот | 242 мг/100 мл |
| Швидкість виділення | 0,1—1,8 мл/хв | Альбуміни | 7,6% |
| Густина | 1,002-1,020 г/см3 | Глобуліни:1 к | 11,1 % |
| рН | 5,6—7,6 (6,75) | ||
| В'язкість лри 38°С | 22-23 | Р | 43,3 % |
| Вода | 99,14—99,42 Ж | Т | 18,1 % |
| Щільні речовини | 0,58—0,86 % | Лізоцим | 18,1 мг/100 мл |
| Гази слини: 0, | 0,5-0,8 % | Муцин | 270,0 мг/100 мл |
| Кисла фосфатаза | 22,0—23,0 мг/мл | ||
| СОз | 8,0—44,0 | Лужна фосфатаза | 5,5—6,0 мг/мл |
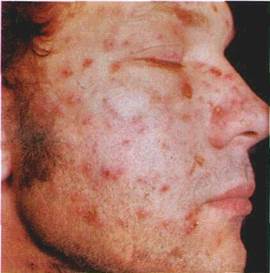
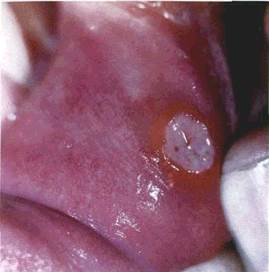
| РОЗДІЛ 4 Елементи ураження слизової оболонки порожнини рота Розвиток будь-якого захворювання СОПР характеризується виникненням на її поверхні своєрідних елементів ураження. Спостережувані на шкірі й CO висипи складаються із окремих елементів, які за їхніми проявами можна об'єднати у декілька груп: І) зміна кольору CO; 2) зміна рельєфу поверхні; 3) обмежене скупчення рідини; 4) нашарування на поверхні; 5) дефекти CO. Елементи ураження умовно поділяють на первинні, що виникають на нез-міненій CO, і вторинні, які є наслідком трансформації чи ушкодження уже існуючих елементів. Утворення однакових первинних елементів на CO розглядають як моно-морфний, а різних — як поліморфний висип. Знання елементів висипу дає змогу правильно орієнтуватися у численних захворюваннях СОПР і губ. А спів-ставлення клінічної картини місцевих змін зі станом всього організму, з чинниками довкілля, що несприятливо впливають як на ділянку ураження, так і на організм у цілому, дає можливість правильно поставити діагноз. До первинних елементів висипу відносять пляму, вузлик (папулу), вузол, горбик, гнояк (пустулу), кісту, пухир, пухирець. Вторинними елементами вважають ерозію, афту, виразку, тріщину, лусочку, екскоріацію, кірку, рубець, ліхенізацію. |
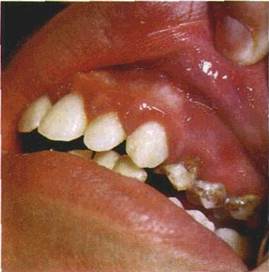
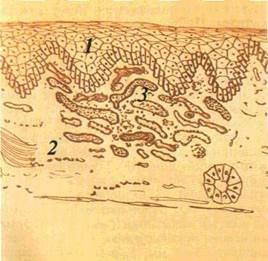
| Мал. 15. Пляма •запального характеру на яснах (а), схематичне її зображення (б): І — епітелій. 2 — власна пластинка слизової оболонки. З — розширені судини |
|
|
| Первинні елементи ураження. Пляма (macula) — зміна кольору СОПР на обмеженій ділянці (мал. 15). Залежно від причин утворення плям колір їх буває різний. Пляма ніколи не виступає над рівнем CO. тобто не змінює її рельєфу. Розрізняють плями судинні, пігментні і такі, що виникають унаслідок відкладання на CO барвних речовин. |
Судинні плями можуть бути наслідком тимчасового розши.-рення судин і запалення. Запальні плями мають забарвлення різних відтінків, частіше червоного, рідше синюватого кольору. При натискуванні на ці плями (діаскопії) вони зникають, а після припинення натискування з'являються знову.
Еритема — необмежене, без чітких контурів почервоніння CO.
Розеола — невеликі круглі еритеми діаметром від 1,5—2 до 10 мм, з обмеженими контурами. Спостерігаються при інфекційних захворюваннях (кір, скарлатина, тиф).
Геморагії — плями, виникнення яких спричинене порушенням цілості судинної стінки. Величина їх різна. Колір таких плям залежить від ступеня розкладання кров'яного пігменту й може бути червоним, синювато-червоним, зеленуватим, жовтим тощо. При діаскопії знебарвлювання геморагій не відбувається. З часом вони зникають безслідно.
Петехії — точкові крововиливи.
Екхімози — великі геморагії округлої або овальної форми.
Телеангіектазії — плями, які з'являються внаслідок стійкого незапального розширення судин або їх новоутворення. Вони формуються тонкими звивистими судинами, що анастомозують між собою. При діаскопії телеангіектазії трохи бліднуть.
Пігментні плями виникають у зв'язку з відкладанням в CO барвних речовин екзо- й ендогенного походження. Вони можуть бути природженими і набутими. Природжені пігментації називають невусами. Набуті пігментації мають ендокринне походження або розвиваються при інфекційних хворобах.
Екзогенна пігментація спричинюється проникненням у CO із зовнішнього середовища речовин, які її забарвлюють. Такими речовинами є виробничий пил, дим, хімічні речовини, зокрема лікарські засоби тощо. Пігментація в разі проникнення в організм важких металів і їх солей має чітко окреслену форму. Колір її залежить від виду металу. Так, колір плям, що спричинені ртуттю, — чорний, свинцем і вісмутом — темно-сірий, сполуками олова — синювато-чорний, цинком — сірий, міддю — зеленуватий, сріблом — чорний, або аспідний.
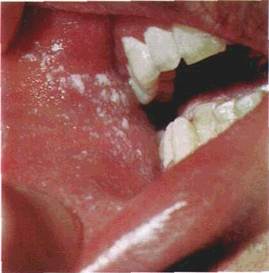
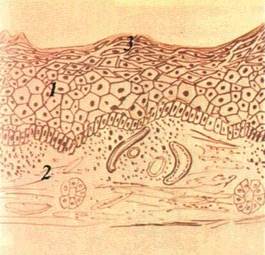
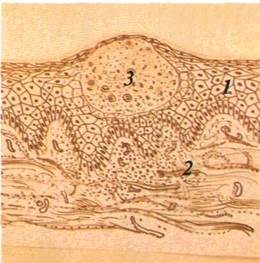
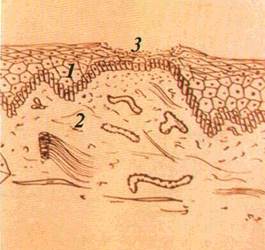
Папула, або вузлик (papula), — безпорожнинний елемент, що виступає над поверхнею CO. Інфільтрат папули знаходиться в сосочковому шарі власної пластинки (мал. 16). Форма папул може бути гострокінцевою, напівкруглою, круглою, кег-леподібною. Діаметр їх становить 3—4 мм. У разі злиття папул утворюються бляшки. При зворотному розвитку папула не залишає сліду.
Вузол (nodus) — обмежене значних розмірів ущільнення (від лісового горіха до курячого яйця), яке сягає підслизової основи (мал. 17). Утворення вузлів може бути наслідком запального процесу, доброякісного і злоякісного пухлинного росту, а також відкладення кальцію і холестерину в товщу тканин.
| Мал. 16. Вузлик (папула) на слизовій оболонці шоки (о), схематичне його зображення (б): І — епітелій. 2 — власна пластинка слизової оболонки. З — підвищення епітелію |
Запальні вузли, сформовані за рахунок неспецифічної і специфічної інфільтрації (при лепрі, скрофулодермі, сифілісі, туберкульозі), швидко збільшуються. Зворотний їх розвиток залежить від різновиду основного захворювання. Вони можуть розсмоктуватися, некротизуватися, розплавлятися з утворенням виразок, а надалі на їх місці — глибоких рубців.
| Мал. 17. Вузол на слизовій оболонці губи (а), схематичне його зображення (б): І — епітелій: 2 — власна пластинка слизової оболонки: -? — розростання тканин |
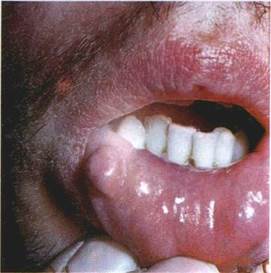
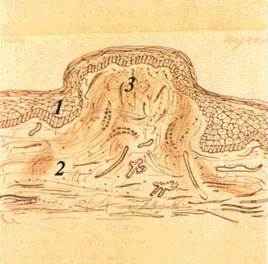
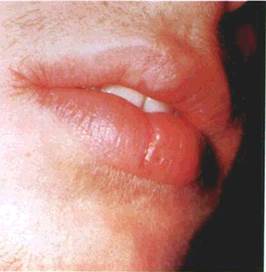
Горбик (tuberculum) — інфільтративний безпорожнинний елемент округлої форми, розміром до горошини, який виступає над рівнем CO (мал. 18). Інфільтрат захоплює всі шари CO. Особливістю горбика, який спочатку буває подібним до вузлика, є те, що центральна його частина, а іноді й увесь елемент, некро-тизується. Це призводить до утворення виразки, яка рубцюється
| Мал. 18. Горбик на слизовій оболонці верхньої губи (а), схематичне його зображення (б): І — епітелій: 2 — власна пластинка слизової оболонки: J — інфільтрат |
або розсмоктується без порушення цілості епітелію, з формуванням рубцевої атрофії. Горбики мають тенденцію до згрупування або злиття. Вони є первинними елементами при вовчаку, горбкуватому сифілісі, лепрі.
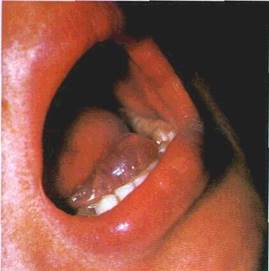
Пухирець (vesiculum) — порожнинний елемент розміром від просяного зерна до горошини, заповнений рідиною. Він
| Мал. 19 Пухирець на нижній губі (а), схематичне його зображення (б) і — епітечіи 2 — власна m стинка счизової оболонки внутрішньоепіте пальна рожнина |
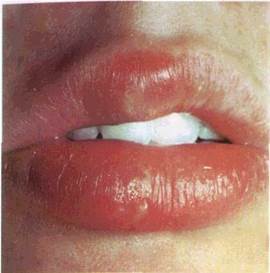
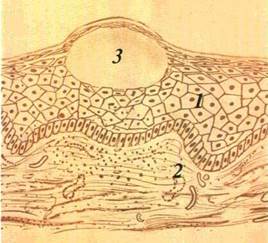
формується у шипуватому шарі епітелію, частіше має серозний, рідше геморагічний вміст (мал. 19) Висипання пухирців може спостерігатися як на незміненій, так і на гіперемійованій і набряклій основі Через те, що стінки пухирця утворені тонким шаром епітелію, його покришка швидко розривається з появою ерозії, по краях якої лишаються обривки пухирця При зворотному
| Маї. 20 Пухир на сли зовіи обочонш язика (а), схематичне його зображення (б) І — епітелій 2 — власна та гинка сіизової оболонки J — пдепітеліальна порожнина |
розвитку пухирець не залишає сліду Нерідко пухирці роз міщуються групами Формування пухирців відбувається внас лідок вакуольної і балонної дистрофії, як правило, при різних вірусних захворюваннях (герпес та ін).
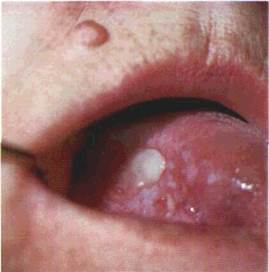
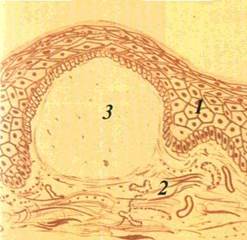
Пухир (bulla) — порожнинний елемент значних розмірів (до курячого яйця), заповнений рідиною (мал 20) Формується
| Mai 21 1 чок нг ш схе \і аєн- |
внутрішньо- чи підепітеліально В ньому розрізняють покришку, дно і вміст Ексудат може бути серозним або геморагічним Покришка підепітеліального пухиря товста, тому він існує на CO довше, ніж внутрішньоепітеліальнии пухир, покришка якого тонка і швидко розривається Ерозія, що утворюється на місці пухиря, загоюється без формування рубця.
| УІал. 22 Кіста слизової оболонки порожнини рота (а), схематичне Гі зображення (б) і — порожнина 2 — епітен аіьна вистпка |
Гнояк (pustula) — обмежене скупчення гнійного ексудату (мал 21) Гнояки бувають первинні й вторинні Первинні гнояки розвиваються на незміненій CO і відразу наповнюються гнійним вмістом білувато-жовтавого кольору Вторинні пустули виникають із пухирців і пухирів Утворення гнояків зу ювлене головним чином дією на епітелій ферментів і токсинів —
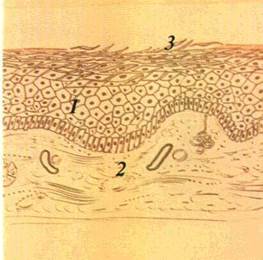
| Мал. 23 Лусочки на нижній губі (а), схематичне їх зображення (б): / — епітелій 2 — власна пластинка слизової обп чіпки -? — лусочки |
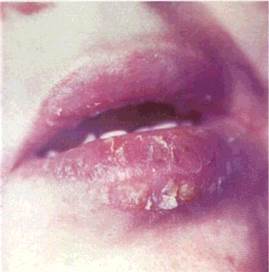
продуктів життєдіяльності стафіло- і стрептококів. Пустули можуть бути поверхневими і глибокими.
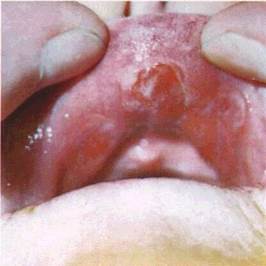
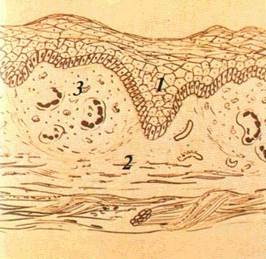
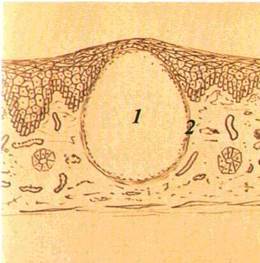
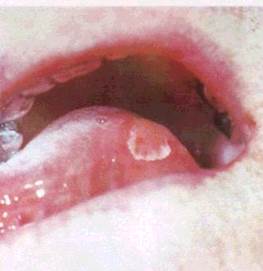
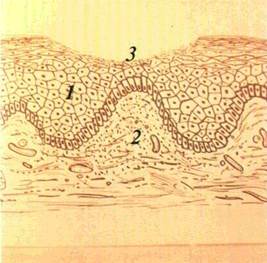
Кіста (cystis) — порожнинний утвір, який має стінку і вміст (мал. 22). Кісти бувають епітеліального походження і ре-тенційні. Останні виникають унаслідок закупорення вивід ної протоки дрібних слизових (слинних) залоз. Епітеліальні кісти
| Мал. 24 Ерозія на слизовій оболонці бічної поверхні язика (а), схематичне й зображення (б): / — епітелій, 2 — власна пластинка слизової оболонки. З — дефект епітелію |
мають сполучнотканинну стінку, вистелену епітелієм. Вміст кісти — серозний, серозно-гнійний або кров'янистий. Ретен-ційні кісти розміщуються на губах, піднебінні й CO щік, наповнені прозорим вмістом, який при інфікуванні стає гнійним.
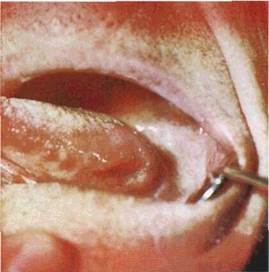
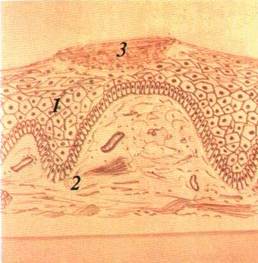
Вторинні елементи ураження. Лусочка (squama) — пластинка, яка складається із десквамованих зроговілих клітин епітелію
| Рис. 25 Афта на слизо він оболонці нижньої г\би (а), схематичне Гі зображення (б) І — епітелій 2 — власна та стинка с-іизової обоїонки З тефект епітеїін ^ ритий фіб ринозним начь •.і |
(мал 23). Лусочки виникають внаслідок гіпер- і паракератозу. як правило, на місцях зворотного розвитку плям, папул, горбиків Бувають різного кольору і розміру. Можуть розвиватися і пер винно- при м'якій лейкоплакії, ексфоліативному хеиліті, іхтіозі Для діагностики уражень з утворенням лусочок мають значення їх розміщення, товщина, колір, розмір, консистенція.
| Мал. 26 Виразка на слизовій оболонці бічної поверхні язика (а), схе •иатичне Гі зображення (б) І епітелій 2 — власна та пика слизової оболонки 3 — (іект епітелію і віасної пла інки сіизової оболонки |
Ерозія (erosio) — дефект поверхневого шару епітелію. Оскільки ураження неглибоке, то після його загоєння не залишається сліду (мал. 24) Ерозія виникає від розриву пухиря, руйнування папул, травматичного ушкодження. При розриві пухиря ерозія повторює його контур. У випадку злиття ерозій утворюються великі ерозивні поверхні з різноманітними контурами.
| Мал. 27 Тріщина червоної кайми нижньої губи (а), схематичне її зображення (6} І — епітелій 2 — віасна та стинка слизової оболонки 3 — лінійний дефект тканин счизо воі оболонки |
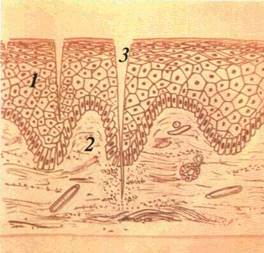
На СОПР ерозивні поверхні можут з'являтися без попереднього пухиря, наприклад, ерозивні папули при сифілісі, ерозив-но виразковій формі червоного плескатого лишаю і червоного вовчака Утворення таких ерозій є наслідком травматизації легко ушкоджуваної запаленої CO. Поверхневий дефект CO, який виникає при механічному ушкодженні, називається екскоріацією
| Мал. 28 Кірка на верхній губі (а), схематичне її зображення (б) і — епітелій 2 — власна пла ^тинка слизової оболонки 3 — кірка (ексудат, що ссохся) |
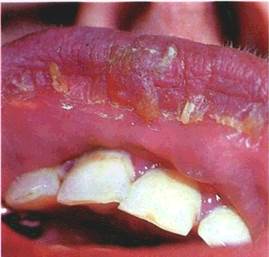
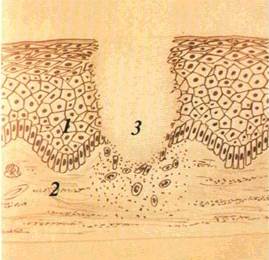
Афта (aphta) — поверхневий дефект епітелію круглої або овальної форми, діаметром 0,3—0,5 мм, розміщений на запа-^eнlй ділянці CO (мал. 25)
Афта вкрита фібринозним випотом, який надає елементу ураження білого або жовтого відтінку. По периферії афта оточена яскраво-червоним обідком
| Мал. 29 Гіпертрофічний рубець на слизовій оболонці нижньоїгуби (а), схематичнейого зображення (б) І — епітени 2 —власна та стинка с-іизовоїоболонки? — вочокнисті утворення |
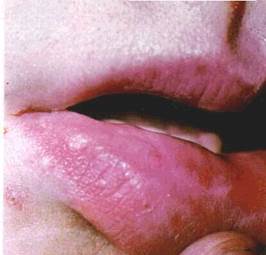
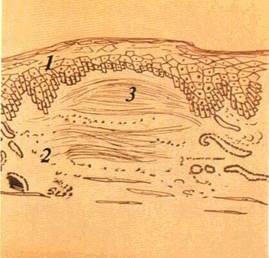
Виразка (ulcus) — дефект CO в межах сполучнотканинного шару (мал 26) Загоєння її відбувається з формуванням глибокого рубця Оскільки утворення виразки властиве цілій низці патологічних процесів, то для полегшення диференціальної діагностики з'ясовують характер ураження' глибину, форму виразки, стан її країв і навколишніх тканин тощо
| Мал. ЗО Атрофічний рубець на нижній поверхні язика (а), схематичне його зображення (б) / _ потоншении епітечіи 2 власна пластинка сіизової обочонки 3 — воіокнисті утворення |
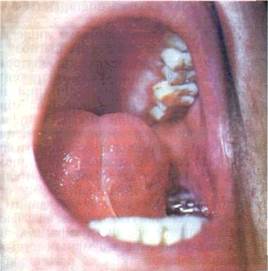
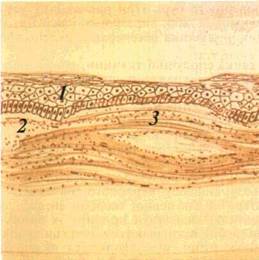
Краї виразки бувають підритими і навислими над дном, прямовисними і блюдцеподібними. Вони, а також дно виразки можуть бути м'якими і твердими Крім того. на дні виразки часто спостерігаються гнійний наліт, некротичні маси, грануляційні розростання. Воно може легко кровоточити при дотику Нерідко краї виразки зберігають рештки основного патологічного
| процесу. Іноді виразка поширюється в підлеглі тканини (м'язи, кістку) і навіть руйнує їх. Слід підкреслити, що сама лише клінічна оцінка виразки є недостатньою для уточнення діагнозу захворювання Необхідно застосувати весь комплекс лабораторних досліджень, а також неодмінно провести загальне обстеження хворого. Тріщина (rhagas) — лінійний надрив CO або червоної кайми губ, який виникає при їх надмірній сухості чи втраті еластичності, а також при запальній інфільтрації (мал 27). Найчастіше тріщини спостерігаються у місцях природних складок або на ділянках, які підлягають травматизації і розтягуванню. Розрізняють поверхневі й глибокі тріщини. Поверхнева тріщина локалізується в межах епітелію, загоюється без рубця. Глибока тріщина поширюється на сполучну тканину власної пластинки, загоюється з формуванням рубця. Кірка (crusta)утворюється внаслщок зсихання ексудату, який витікає післяпроривання пухиря, пухирця, пустули (мал 28). Кірка являє собою сумішкоагульованої тканинної рідини і плазми крові, а також клітин крові, що розпалися, та епітеліальнихклітин Коліркірок залежить від характеру ексудату У разі зсихання серозного ексудату формуються сірувато-чи медово-жовтікірки, гнійного — брудно-сіріабо зеленувато-жовті, геморагічного —кров'янисто-бурі. При насильному усуненнікірки оголюєтьсяерозивна або виразкова поверхня, а після природного відпадіння — ділянкарегенерації, рубець або рубцеваатрофія Рубець(cicatrix) — ділянка сполучної тканини, що заміщає дефектCO, якийвиник приїї ушкодженні чи патологічному процесі Рубець складаєтьсяв основному із колагенових волокон, покритийтонким шаром епітелію, в якому відсутні епітеліальнівиступи. Форма і глибина рубціврізні. Розрізняютьгіпертрофічні й атрофічні рубці. Гіпертрофічні (келоідні) рубці(мал. 29)виникають після травми і хірургічних втручань.Вони маютьлінійну форму, щільні, часто обмежують рухомість CO Атрофічні рубці (мал. ЗО) утворюються після загоєння елементівтуберкульозу, сифілісу, червоного вовчака. Такі рубці маютьхарактерний дляпевної хвороби вигляд, за яким можна з великоюточністю визначити причину їх виникнення.Так, післявовчаковірубці відзначаються неправильною формою і значноюглибиною; рубці, що утворилися після загоєння туберкульозноївиразки, порівняно неглибокі, після гуми — гладенькі, втягнені. При природженому сифілісі рубці променеподібні, розташовуються навколо рота |
| РОЗДІЛ 5 Загальні уявлення про захворювання слизової оболонки порожнини рота та їх систематика (класифікація) Серед стоматологічних захворювань особливе місце посідають процеси, пов'язані з ураженням СОПР. Підвищена увага, яку приділяють цій патології науковці і практичні лікарі, пов'язана із значною частотою захворювань СОПР, великою різноманітністю їх форм, широким спектром етіологічних чинників і доволі складним, а в багатьох випадках не досить ясним патогенетичним механізмом цих уражень. Слід відзначити, щов останнє десятиріччя у вітчизнянійі зарубіжнійлітературі з'явилисяокремі повідомлення, що свідчать проглибокі дослідження цієї проблеми.Однак ще багато аспектів захворювань CO потребують дальшого вивчення, деталізації й конкретизації з метоюрозробленняефективних методів лікування і профілактики цих хвороб. Нині в літературі відсутні статистичні дані, які відображають частоту і кількість захворювань, що супроводжуються ураженнями СОПР. Не завжди є однозначна відповідь на питання, які зміни CO є самостійними процесами, а які виникають як симптоми органної і загальносоматичної патології, які захворювання СОПР є синдромами тощо. Ми спробувалиузагальнитивідомості про захворюванняСОПР, щонайчастіше наводяться увітчизняних |
та зарубіжних посібниках. За нашими попередніми даними, на цей час загальна кількість описаних захворювань, в тому числі й тих, що рідко трапляються, становить близько 1000 нозологічних одиниць.
Однією із причин, що утруднюють створення повного уявлення про захворювання СОПР, є досить велика різноманітність факторів їхнього розвитку. Це характерно навіть для тих спостережень, коли клінічні прояви хвороб закономірно однакові і механізм їх розвитку єдиний 3 цієї точки зору, повне розуміння суті того чи іншого захворювання СОПР можливе лише при аналізі етіологічних, патогенетичних факторів і клінічних проявів хвороби як єдиного причинно-наслідкового процесу Такий підхід багато дослідників використовували при створенні ґрунтовних класифікацій захворювань СОПР Розглядаючи його як найбільш раціональний і методично вірний, коротко зупинимося на окремих ланках цього ланцюга
Етіологія. Свого часу, на ранніх етапах вивчення захворювань СОПР, всі ці патологічні процеси об'єднували під спільним діагнозом «стоматит». У подальшому, в міру накопичення великого фактичного матеріалу, клінічного досвіду, з'явилися спроби систематизувати захворювання СОПР, об'єднати деякі із них в окремі групи, що спричинило появу таких діагностичних термінів, як «хейліт», «гінгівіт», «глосит», «палатиніт» та ін. Зазначені діагностичні підходи стали помітним кроком уперед у різнобічному вивченні цих захворювань, зокрема, дали можливість докладніше розглядати закономірності клінічних симптомів, характерних для ураження окремих ділянок СОПР (губа, ясна, піднебіння тощо), а також їх причини, механізми розвитку, особливості перебігу.
Серед спеціалістів давно склалося переконання в тому, що основою більшості захворювань СОПР і підстеляючих тканин є численні причини як екзо-, так і ендогенного характеру, нерідко — їх поєднання і взаємозумовлений вплив.
За кількістю й різноманітністю етіологічних чинників захворювання СОПР є провідними серед захворювань органів і систем людини. Твердження окремих дослідників про мо
 2015-09-06
2015-09-06 2427
2427
