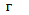Щоразу, застосовуючи на практиці методи термодинаміки (розрахунки теплових двигунів, холодильних машин тощо) досить часто доводиться мати справи з ізопроцесами в газах, тобто з такими процесами, під час перебігу яких один з основних параметрів (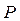 ,
, 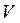 чи
чи 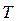 ) і маса газу не змінюються. Розглянемо деякі з них.
) і маса газу не змінюються. Розглянемо деякі з них.
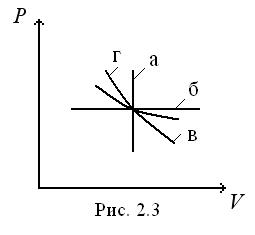
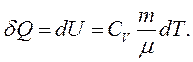 Ізохорний процес – процес, що відбувається за постійного об’єму газу. У координатах Р-V він має вигляд прямої, що називають ізохорою (рис. 2.3а). Оскільки
Ізохорний процес – процес, що відбувається за постійного об’єму газу. У координатах Р-V він має вигляд прямої, що називають ізохорою (рис. 2.3а). Оскільки 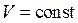 , то
, то 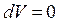 ,
, 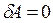 і для ізохорного процесу рівняння (2.14) набирає вигляду:
і для ізохорного процесу рівняння (2.14) набирає вигляду:
(2.16)
Тобто уся теплота, отримана системою в ізохорному процесі, витрачається на зміну її внутрішньої енергії.
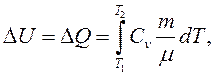 При зміні температури газу від Т1 до Т2 зі збереженням об’єму зміна його внутрішньої енергії та кількість наданої йому теплоти може бути виражена рівнянням:
При зміні температури газу від Т1 до Т2 зі збереженням об’єму зміна його внутрішньої енергії та кількість наданої йому теплоти може бути виражена рівнянням:
(2.17)
а теплоємність одного моля за постійного об’єму:
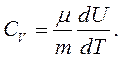
(2.18)
Ізобарний процес – процес, що відбувається за постійного тиску. У координатах  він зображується прямою, названою ізобарою (рис. 2.3б). На основі рівняння Мендєлєєва-Клапейрона при
він зображується прямою, названою ізобарою (рис. 2.3б). На основі рівняння Мендєлєєва-Клапейрона при  знаходимо:
знаходимо:
|
|
|
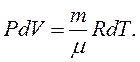
З урахуванням цього, а також рівнянь (2.10) та (2.16), рівняння (2.14) набуває вигляду:
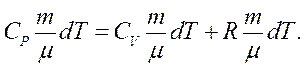 (2.19)
(2.19)
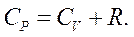 З цього рівняння знаходимо зв'язок між молярною теплоємністю газу за постійного тиску
З цього рівняння знаходимо зв'язок між молярною теплоємністю газу за постійного тиску 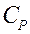 і його молярною теплоємністю при постійному об'ємі
і його молярною теплоємністю при постійному об'ємі 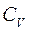 : (2.20)
: (2.20)
Це співвідношення називають рівнянням Р. Майєра.
Зі співвідношення 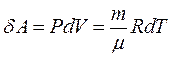 знаходимо:
знаходимо:
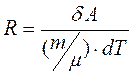 . (2.21)
. (2.21)
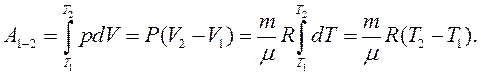 З рівняння (2.21) випливає, що універсальна газова стала R чисельно дорівнює роботі, виконаній одним молем ідеального газу під час його ізобарного нагрівання на один градус. Робота, виконана в ізобарному процесі 1–2:
З рівняння (2.21) випливає, що універсальна газова стала R чисельно дорівнює роботі, виконаній одним молем ідеального газу під час його ізобарного нагрівання на один градус. Робота, виконана в ізобарному процесі 1–2:
(2.22)
Ізотермічний процес – процес, що відбувається за постійної температури. У координатах Р-V він зображується рівнобічною гіперболою (рис. 2.3в), яку називають ізотермою. Оскільки при 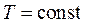 ,
, 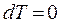 і
і 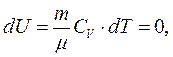 то рівняння першого закону термодинаміки для цього процесу набуває вигляду:
то рівняння першого закону термодинаміки для цього процесу набуває вигляду:
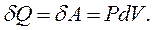 |
(2.23)
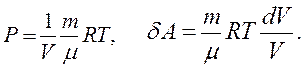 На основі рівняння Мендєлєєва-Клапейрона знаходимо:
На основі рівняння Мендєлєєва-Клапейрона знаходимо:
(2.24)
 Уся теплота
Уся теплота  , яка була надана газу в ізотермічному процесі, витрачається на здійснення газом роботи проти зовнішніх сил:
, яка була надана газу в ізотермічному процесі, витрачається на здійснення газом роботи проти зовнішніх сил:
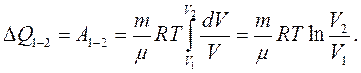
|
|
|
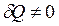 , а
, а 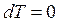 .
.
Адіабатний процес – процес, що відбувається без теплообміну між системою та зовнішнім середовищем. Його широко застосовують у циклах двигунів внутрішнього згоряння, холодильних установках тощо. Для такого процесу 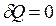 , і рівняння першого закону термодинаміки має вигляд:
, і рівняння першого закону термодинаміки має вигляд:
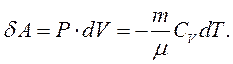 |
(2.26)
Робота в адіабатному процесі виконується за рахунок внутрішньої енергії системи (газу). На основі рівняння Мендєлєєва–Клапейрона знаходимо:
|
|
|
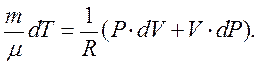 |
Підставивши це значення в рівняння (2.26), отримаємо:
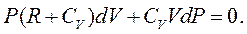 |
Оскільки 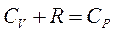 , то
, то 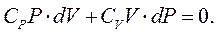
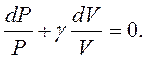 Розділимо це рівняння на
Розділимо це рівняння на 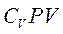 , позначивши
, позначивши 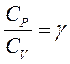 , отримаємо:
, отримаємо:
(2.27)
Приймаючи 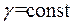 , що в не дуже великому інтервалі звичайних температур практично вірно, проінтегруємо останнє рівняння й отримаємо:
, що в не дуже великому інтервалі звичайних температур практично вірно, проінтегруємо останнє рівняння й отримаємо:
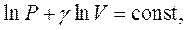
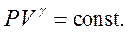 звідки:
звідки:
(2.28)
Це рівняння називають рівнянням Пуассона, а лінію, що зображує адіабатний процес, називають адіабатою. У координатах 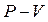 вона представлена на рис. 2.3 г.
вона представлена на рис. 2.3 г.
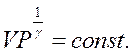 Розділивши рівняння
Розділивши рівняння 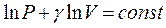 на
на 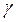 і спотенціювавши результат ділення, отримаємо:
і спотенціювавши результат ділення, отримаємо:
(2.29)
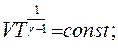
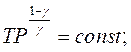
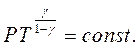
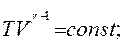 Якщо за рівнянням Мендєлєєва–Клапейрона виразити тиск
Якщо за рівнянням Мендєлєєва–Клапейрона виразити тиск 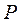 і об'єм
і об'єм 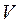 і підставити їх послідовно в рівняння (2.28)і (2.29), то після незначних математичних перетворень можна одержати рівняння адіабати, виражені через параметри
і підставити їх послідовно в рівняння (2.28)і (2.29), то після незначних математичних перетворень можна одержати рівняння адіабати, виражені через параметри 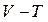 і
і 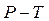 :
:
(2.30)
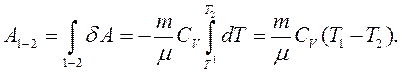 Роботу
Роботу 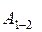 , яка виконується газом в адіабатному процесі 1-2, знайдемо на основі рівняння (2.26):
, яка виконується газом в адіабатному процесі 1-2, знайдемо на основі рівняння (2.26):
(2.31)
На основі рівнянь (2.20) і (2.27) знаходимо:
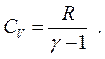 (2.32)
(2.32)
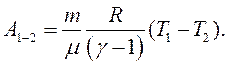 Підставимо це значення
Підставимо це значення 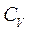 у рівняння (2.31) і знайдемо:
у рівняння (2.31) і знайдемо:
(2.33)
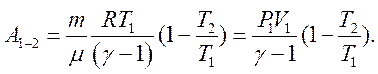 Розділивши й помноживши праву частину цього рівняння на
Розділивши й помноживши праву частину цього рівняння на 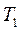 і з огляду на рівняння Мендєлєєва–Клапейрона, отримаємо:
і з огляду на рівняння Мендєлєєва–Клапейрона, отримаємо:
(2.34)
На основі рівнянь адіабат 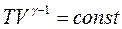 і
і 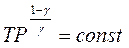 знаходимо:
знаходимо:
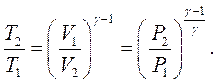
Підставивши ці значення в рівняння (2.33), отримаємо:
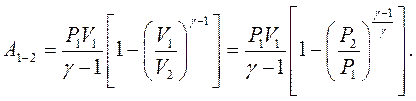 |
(2.35)
Політропні процеси – це процеси, при протіканні яких теплоємність тіла залишається постійною. Одержимо рівняння політропи на основі першого закону термодинаміки. Якщо з рівняння Клапейрона-Мендєлєєва виразити 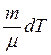 і підставити в рівняння
і підставити в рівняння 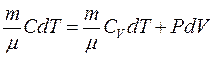 , то з урахуванням рівняння
, то з урахуванням рівняння 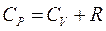 , після деяких перетворень, можна отримати:
, після деяких перетворень, можна отримати:
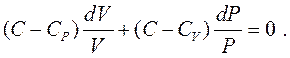
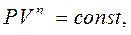 Інтегруючи це рівняння, отримаємо:
Інтегруючи це рівняння, отримаємо:
(2.36)
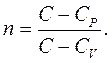 |
де
 (2.37)
(2.37)
|
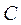 – молярна теплоємність в умовах розглянутого процесу. Рівняння (2.36) і є шукане рівняння політропи.
– молярна теплоємність в умовах розглянутого процесу. Рівняння (2.36) і є шукане рівняння політропи.
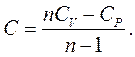 Із рівняння (2.37) знаходимо:(2.38)
Із рівняння (2.37) знаходимо:(2.38)
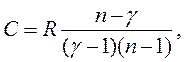 Скориставшись співвідношеннями (2.20), (2.32) і (2.38), одержимо
Скориставшись співвідношеннями (2.20), (2.32) і (2.38), одержимо
(2.39)
де 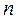 – показник політропи,
– показник політропи, 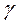 – показник адіабати.
– показник адіабати.
На основі рівнянь (2.36) – (2.39) легко показати, що рівняння політропи охоплює усі раніше описані ізопроцеси. Так, при 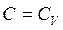
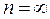 . За цих умов рівність (2.36) виконується при
. За цих умов рівність (2.36) виконується при 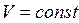 , що відповідає ізохорному процесу. Якщо
, що відповідає ізохорному процесу. Якщо 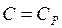 , то
, то 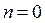 і
і 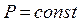 ,що відповідає ізобарному процесу. Рівняння (2.36) переходить у рівняння ізотерми
,що відповідає ізобарному процесу. Рівняння (2.36) переходить у рівняння ізотерми 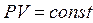 при
при 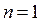 . При цьому відповідно до рівняння (2.38),
. При цьому відповідно до рівняння (2.38), 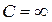 , що відповідає ізотермічному процесу. Нарешті, при заміні
, що відповідає ізотермічному процесу. Нарешті, при заміні 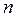 на
на 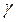 теплоємність
теплоємність 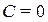 і політропа (2.36) переходить в адіабату (2.28).
і політропа (2.36) переходить в адіабату (2.28).
Робота, виконана ідеальним газом у процесі 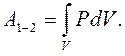 .
.
Оскільки 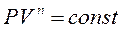 , то
, то 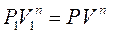 , а
, а 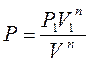 , де
, де 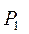 і
і 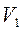 – тиск й об'єм газу на початку процесу.
– тиск й об'єм газу на початку процесу.
Тоді:
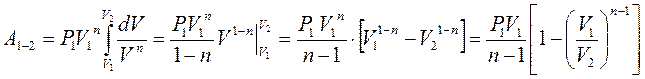
(2.40)
 2015-09-06
2015-09-06 1676
1676