| Термохимическое уравнение реакции – уравнение реакции, включающее тепловой эффект реакции, рассчитанный на количества вещества, задаваемые коэффициентами этого уравнения. |
Тепловой эффект реакции зависит а) от агрегатных состояний исходных веществ и продуктов реакции, б) от температуры и в) от того, происходит ли химическое превращение при постоянном объеме или при постоянном давлении. Зависимость теплового эффекта реакции от агрегатного состояния веществ связана с тем, что процессы перехода из одного агрегатного состояния в другое (как и некоторые другие физические процессы) сопровождаются выделением или поглощением теплоты. Это также может быть выражено термохимическим уравнением. Пример – термохимическое уравнение конденсации водяного пара:
Н2О(г) = Н2О(ж), ∆rH<0.
В термохимических уравнениях, а при необходимости и в обычных химических уравнениях, агрегатные состояния веществ указываются с помощью буквенных индексов: г) – газ, (ж) – жидкость, (т) или (кр) – твердое или кристаллическое вещество.
|
|
|
Зависимость теплового эффекта от температуры связана с различиями в теплоемкостяхисходных веществ и продуктов реакции. Так как в результате экзотермической реакции при постоянном давлении всегда увеличивается объем системы, то часть энергии уходит на совершение работы по увеличению объема, и выделяющаяся теплота будет меньше, чем в случае протекания той же реакции при постоянном объеме.
Тепловые эффекты реакций обычно рассчитывают для реакций, протекающих при постоянном объеме при 298 К и постоянном давлении 105 Па. Эти условия называются стандартными.
При выделении теплоты энтальпия системы уменьшается. Отсюда старое название этой величины: " теплосодержание".
Термохимические уравнения, записанные с использованием изменения энтальпии, называются термохимическими уравнениями в термодинамической форме. При этом приводится значение изменения энтальпии в стандартных условиях (298 К, 101,3 кПа), обозначаемое 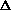 r Hо. Например:
r Hо. Например:
2Н2(г) + О2(г) = 2Н2О(г); 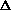 r Hо = – 484 кДж;
r Hо = – 484 кДж;
CaO(кр) + H2O(ж) = Сa(OH)2(кр); 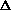 r Hо = – 65 кДж.
r Hо = – 65 кДж.
Зависимость количества теплоты, выделяющейся в реакции (Q) от теплового эффекта реакции (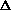 r Hо) и количества вещества (n Б) одного из участников реакции (вещества Б – исходного вещества или продукта реакции) выражается уравнением:
r Hо) и количества вещества (n Б) одного из участников реакции (вещества Б – исходного вещества или продукта реакции) выражается уравнением:
· 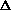 r Hо r Hо
|
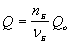
(2.1)
Здесь νБ – количество вещества Б, задаваемое коэффициентом перед формулой вещества Б в термохимическом уравнении.
 2015-09-06
2015-09-06 1679
1679








