ХИМИЧЕСКОЕ РАВНОВЕСИЕ
Химические реакции часто являются двусторонними (обратимыми), т.е. могут протекать при данных условиях в двух противоположных направлениях (понятие обратимая реакция следует отличать от термодинамического понятия обратимый процесс; двусторонняя реакция обратима в термодинамическом смысле лишь в состоянии химического равновесия). Рассмотрим элементарную двустороннюю реакцию
nА + mВ <––>fD + cE
Скорость уменьшения концентрации вещества А при протекании прямой реакции определяется уравнением:
υ = k1 сАncBn,
а скорость возрастания концентрации вещества А в результате протекания обратной реакции – уравнением:
υ = k2 сDfcEc.
По мере протекания двусторонней реакции скорость прямой реакции уменьшается, скорость обратной реакции – увеличивается; в некоторый момент времени скорости прямой и обратной реакции становятся равными и концентрации реагентов перестают изменяться. Таким образом, в результате протекания в закрытой системе двусторонней реакции система достигает состояния химического равновесия; при этом константа равновесия будет равна отношению констант скоростей прямой и обратной реакции:
|
|
|
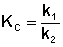 ,
,
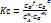
Пример. Напишите выражение для константы равновесия гомогенной системы CO(г) + H2O(г) ↔ CO2(г) + H2(г).
Решение. Из кинетического условия состояния химического равновесия (υпр = υобр) следует выражение для константы равновесия:
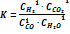
При изменении внешних условий (концентрации, температуры, давления) изменяются скорости реакции, и происходит смещение равновесия.
 2015-09-06
2015-09-06 557
557








