Дальнейшее обсуждение масс спектров ограничивается масс-спектрометрией с ионизацией электронным ударом. Фрагментация в этом случае несет богатую информацию о структуре.
Масс –спектры обычно получают при энергии электронного пучка 70 эВ. В простейшем случае молекула в газовой фазе под действием электронного удара теряет один электрон, что приводит к образованию молекулярного иона, который представляет собой катион-радикал. Например, метанол образует молекулярный ион, как показано на схеме 1. Одна точка означает оставшийся нечетный электрон; когда заряд локализуется на отдельном атоме, знак заряда указывается на этом атоме.
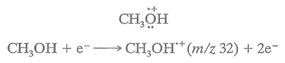
Схема 1.
Многие из этих молекулярных ионов распадаются за время от 10-10 до 10-3 с и дают в простейшем случае положительно заряженный осколок и радикал. Так образуется ряд осколочных ионов, каждый из которых может распасться на еще более мелкие фрагменты. Возможные пути распада для метанола показаны на схеме 2.
CH3OH · + → CH2OH+ (m/z 31) + H ·
CH3OH · + → CH3+ (m/z 15) + · OH
|
|
|
CH2OH+ → CHO+ (m/z 29) + H2
Схема 2.
Если некоторые из молекулярных ионов имеют достаточно большое время жизни, то они достигают детектора и регистрируются в виде пика молекулярного иона. Распознать эти пики очень важно, так как они дают молекулярную массу изучаемого соединения.
Масс-спектр – это представление относительных концентраций положительно заряженных осколков (включая молекулярный ион) в зависимости от их масс. Высота наиболее интенсивного в спектре пика, называемого максимальным (основным), принимается за 100%, а интенсивности (высота, умноженная на коэффициент чувствительности) других ионов, включая пик молекулярного иона, выражаются в процентах от максимального пика. Конечно, иногда максимальным пиком может быть и пик молекулярного иона. На рис. 17 пик молекулярного иона имеет величину m/z 121, а максимальный пик m/z 77. Пик молекулярного иона обычно является пиком с наибольшим массовым числом, за исключением пиков изотопных ионов.
Идентификация пика молекулярного иона.
Распознавание пика молекулярного иона (М)+ в спектрах с ионизацией электронным ударом довольно часто представляется проблематичным. Этот пик может оказаться очень слабым или не появиться совсем. Часто лучшее решение состоит в регистрации масс-спектра с химической ионизацией; при этом получается спектр с интенсивным пиком (М+1)+ при незначительной фрагментации. Многие пики можно исключить из числа возможных пиков молекулярных ионов на основе разумных структурных ограничений. Часто бывает полезным “азотное правило”. Оно устанавливает, что молекула с четной молекулярной массой либо не должна содержать азот, либо число атомов азота должно быть четным; нечетная молекулярная масса требует нечетного числа атомов азота. Это правило справедливо для всех соединений, содержащих углерод, водород, кислород, азот, серу и галогены, а также многие другие реже встречающиеся атомы, такие как фосфор, бор, кремний, мышьяк и щелочноземельные металлы.
|
|
|
Интенсивность пика молекулярного иона зависит от стабильности самого иона. Наиболее устойчивыми молекулярными ионами являются ионы чисто ароматических систем. В общем случае способность органических соединений давать пик молекулярного иона уменьшается в ряду
ароматические соединения > сопряженные алкены > насыщенные циклические соединения > органические сульфиды > неразветвленные алканы с короткими цепями > тиолы.
Определение молекулярной формулы
 2015-10-14
2015-10-14 937
937








