САРКОПЛАЗМАТИЧЕСКИЕ БЕЛКИ: протеины, растворимые в солевых средах с низкой ионной силой
1) дыхательный пигмент миоглобин
2) разнообразные белки-ферменты, локализованные главным образом в митохондриях и катализирующие процессы тканевого дыхания, окислительного фосфорилирования, а также многие стороны азотистого и липидного обмена
3) парвальбумины, которые способны связывать ионы Са2+.
МИОФИБРИЛЛЯРНЫЕ БЕЛКИ: белки, растворимые в солевых средах с высокой ионной силой
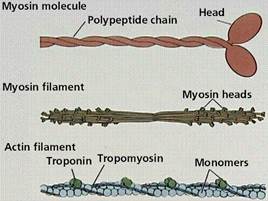
1) Миозин- составляет 50–55% от сухой массы миофибрилл. Молекула миозина имеет сильно вытянутую форму, длину 150 нм. Она может быть расщеплена без разрыва ковалентных связей на субъединицы: две тяжелые полипептидные цепи (Н) с мол. массой 205000–210000 и несколько коротких легких цепей (L,)мол. масса которых около 20000. Тяжелые цепи образуют длинную закрученную α-спираль («хвост» молекулы), конец каждой тяжелой цепи совместно с легкими цепями создает глобулу («головка» молекулы).Эти «головки» выдаются из основного стержня молекулы. «Головка» миозина имеет сайт связывания с актином и сайт связывания АТФ. Количество легких цепей в молекуле миозина у различных видов животных и в разных типах мышц неодинаково. По количеству "головок" миозины делятся на "традиционные" (convention myosin)- 2 головки, и нетрадиционные (unconvention myosin) - одна "головка". Традиционные миозины могут связываться между собой в протофибриллы, а нетрадиционные - не могут.
|
|
|
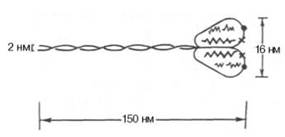
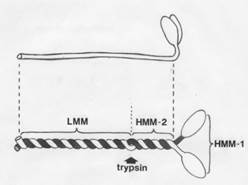
При расщеплении кратковременным действием трипсина образуются два фрагмента, к-рые наз. легким и тяжелым меромиозинами (обозначаются соотв. LMM и НММ). LMM представляет собой фрагмент стержневой части молекулы М. длиной ок. 80 нм и с мол.м. 150 тыс. НММ содержит головку М. и часть хвоста, его длина 60-70 нм, мол. м. ок. 340 тыс.
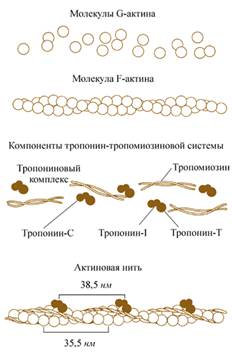
2) Актин. Две формы актина:
· глобулярный актин (G-актин)
· фибриллярный актин (F-актин).
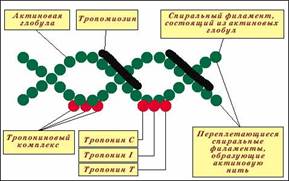
Молекула G-актина с мол. массой 42000 состоит из одной полипептидной цепочки (глобула), в образовании которой принимают участие 374 аминокислотных остатка. При повышении ионной силы до физиологического уровня G-актин полиме-ризуется в F-актин (фибриллярная форма). На электронных микрофотографиях волокна F-актина выглядят как две нити бус, закрученных одна вокруг другой
3) Актомиозин- образуется при соединении миозина с F-актином. Ак-томиозин, как естественный, так и искусственный, т.е. полученный путем соединения in vitro высокоочищенных препаратов миозина и F-актина, обладает АТФазной активностью, которая отличается от таковой миозина, АТФазная активность миозина значительно возрастает в присутствии стехиометрических количеств F-актина. Фермент актомиозин активируется ионами Mg2+и ингибируется этилендиаминтетраацетатом (ЭДТА) и высокой концентрацией АТФ, тогда как миозиновая АТФаза ингибируется ионами Mg2+, активируется ЭДТА и не ингибируется высокой концентрацией АТФ.
|
|
|
Регуляторные белки:
1) Тропомиозин- состоит из двух α-спиралей и имеет вид стержня длиной 40 нм; его мол. масса 65000. На долю тропомиозина приходится около 4–7% всех белков миофибрилл.
2) Тропонин- составляет лишь около 2% от всех миофибриллярных белков. В его состав входят три субъединицы (Тн-I, Тн-С, Тн-Т). Тн-I (ингибирующий) может ингибировать АТФазную активность, ТН-С (кальцийсвязывающий) обладает значительным сродством к ионам кальция, Тн-Т (тропомиозин-связывающий) обеспечивает связь с тропомиозином. Тропонин, соединяясь с тропомиозином, образует комплекс, названный нативным тропомиозином. Этот комплекс прикрепляется к актиновым филаментам и придает актомиозину скелетных мышц позвоночных чувствительность к ионам Са2+
БЕЛКИ СТРОМЫ:
1) Коллаген
2) Эластин
НЕБЕЛКОВЫЕ АЗОТИСТЫЕ ЭКСТРАКТИВНЫЕ ВЕЩЕСТВА:
1) адениновые нуклеотиды (АТФ, АДФ и АМФ)
2) нуклеотиды неаде-нинового ряда
3) 
 креатинфосфат
креатинфосфат
4) креатин
5)
|
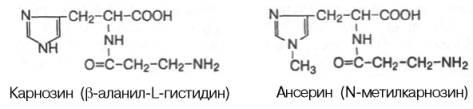
6)  карнозин
карнозин
7) ансерин
8) свободные аминокислоты: глутаминовая кислота, глутамин
9) мочевина, мочевая кислота, аденин, гуанин, ксантин и гипоксантин – встречаются в мышечной ткани в небольшом количестве и, как правило, являются либо промежуточными, либо конечными продуктами азотистого обмена.
БЕЗАЗОТИСТЫЕ ВЕЩЕСТВА:
1) Гликоген- концентрация колеблется от 0,3 до 2% и выше
2) Глюкоза, гексозофосфаты- следовые количества
 2015-10-16
2015-10-16 1006
1006







