В растворах сильных электролитов межионное взаимодействие является главной причиной кажущегося уменьшения концентрации ионов.
Есть аналитическая (обычная) концентрация электролита, которую вычисляют исходя из состава раствора и его плотности. В физико-химических свойствах раствора проявляется кажущаяся или эффективная концентрация, называемая активностью a. Математически она выражается следующим образом:
a = f · c
где f – коэффициент активности, c – аналитическая концентрация. По мере разбавления раствора значение f приближается к единице, а активность a – к концентрации c.
Основная задача теории сильных электролитов заключается в вычислении или экспериментальном определении коэффициентов активности разных электролитов. По теории Дебая-Хюккеля для очень разбавленных водных растворов коэффициент активности иона вычисляется по формуле
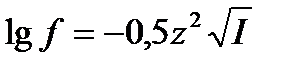 ,
,
где z – заряд иона, I – так называемая ионная сила раствора, определяемая как половина суммы произведений концентраций ионов на квадраты их зарядов:
|
|
|
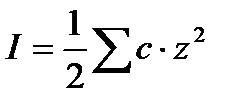
Раствор может содержать несколько веществ электролитов. Суммирование должно производиться по всем имеющимся ионам.
Практически, коэффициенты активности редко вычисляют по формуле Дебая-Хюккеля. Их находят по таблицам для конкретного иона в зависимости от ионной силы раствора.
Коллигативные свойства растворов электролитов.
В растворах электролитов содержится большее число кинетически независимых частиц по отношению к не электролиту с той же молярной концентрацией. Следствие этого было обнаружено Вант-Гоффом. Осмотическое давление, Δ Т з и Δ Т к имеют значения, в 2 и более раз превышающие те, которые вычисляются по формулам законов Вант-Гоффа и Рауля. В обычные формулы, определяющие коллигативные свойства, Вант-Гофф ввел так называемый изотонический коэффициент:
Δ T з, электролит = i · K · b;
Δ T к, электролит= i · E · b;
πэлектролит= i · c · R · T
Предельное значение изотонического коэффициента равно целому числу, совпадающему с числом ионов, на которые распадается структурная единица электролита. Так, у хлорида натрия i пред = 2; у хлорида кальция CaCl2 i пред = 3; у хлорида алюминия AlCl3 i пред = 4. В растворах с достаточно высокой концентрацией изотонический коэффициент существенно меньше ожидаемого целого числа вследствие понижения активности ионов.
Среди электролитов в организме человека в наибольшем количестве присутствует хлорид натрия. На его долю приходится около 93% осмотического давления плазмы. Внутривенно можно вводить только растворы, изотоничные плазме крови. Простейшим из таких растворов является физиологический раствор хлорида натрия с массовой долей NaCl 0,9% (ρ = 1,0047 г/мл). Его молярная концентрация 154,7 ммоль/л. Применяются и более сложные рецептуры заменяющих плазму растворов, приближенные к минеральному составу плазмы.
 2015-10-16
2015-10-16 495
495







