ТЫЛ Лекция 3
Тема 1. Основные понятия и законы химии
Занятие 5. Строение атома.
План:
Строение атома
Современное представление о строении атома
Распределение электронов по энергетическим уровням и орбиталям
Взаимосвязь строения атомов с периодическим законом и периоди-
Ческой системой элементов Д.И. Менделеева
Литература:
1Басов В.П.,Родіонов В.М., Юрченко О.Г Навчальний посібник, К.
„Каравела „ 2003
2. Барсукова З.А. Аналитическая химия, М. Высшая школа, 1990
3. Глінка М.Л. Загальна хімія, К. Вища школа, 1976
5. Глінка М.Л. Задачі і вправи з загальної хімії, К. Вища школа, 1983
4. Дроздов В.О., Горліченко М.Г., Шевченко С.В. Завдання для самостійних занять з хімії, ОІСВ, 2002
5. Курс общей химии, под ред. Коровина Н.М., М. Высшая школа,1
6. Некрасов Б.В. Основы общей химии, М. Химия, 1974
7. Новиков Г.И. Основы общей химии, М. Высшая школа, 1994
8. Поллинг Л. Общая химия, перевод с англ.., М. Высшая школа, 1990
9. Попадуч І.А., Таунбергер С.Є. Аналітична хімія, К. Вища школа, 1989
10. Софронков О.Н. і група викладачів Хімія (частина 1) ОІСВ, 1993, 2002
11. Софронков О.Н. і група викладачів, Аналітична хімія (частина 2), ОІСВ,
12. Софронков О.Н. і група викладачів Задачі, вправи та алгоритми їх рішення,
ОІСВ, 1994
13. Софронков О.Н. і група викладачів Хімія (довідкові матеріали), ОІСВ,1998
14. Горличенко М.Г., Шевченко С.В. Хiмiя (навчаль. посiбн.), ОІСВ,2004
15. Хомченко Г.П. Химия.,М., Висшая школа..1989
Строение атомов
С древних времен и до конца XIX в. только предполагалось существова- ние атомов – мельчайших неделимых частиц, из которых построены молеку- лы простых и сложных веществ. Однако, «неделимость» атома вызвала у многих ученых большой вопрос.
Действительное существование атомов и их сложность строения уда- лось доказать к концу XIX и в начале XX века благодаря бурному развитию экспериментальной физики: были открыты катодные лучей (Ж. Перрон, франция, Д. Томсон, англия, 1895), состоящие из потока отрицательно заря- женных частиц - электронов (массой 0,00055 а.е.м.,что в 1840 раз меньше массы ядра атома водорода). Таким образом, была открыта первая составная часть атома – электрон, несущий отрицательный заряд. Позже были открыты х -лучи или рентгеновские лучи (электромагнитные волны) (В.К. Рентген, германия,1896), радиоактивность (А.А. Беккерель,, П.Кюри и М. Складов-
ская-Кюри, франция,1896-1898), α-, β- и γ-лучи.
Альфа-лучи -потокположительно заряженных частицы протонов (яд- ер атома гелия массой 4 а.е.м). Таким образом, была открыта вторая состав- ная часть атома – ядро атома, несущее положительный заряд.
Бета-лучи - поток электронов (отрицательно заряженных частиц).
Гамма-лучи подобно рентгеновским лучам являлись электромагнитными волнами, не несущими заряд.
Эти открытия положили конец представлению о неделимости атома и, следовательно, указывали на его сложное строение: атом – сложная частица, состоящая из положительно заряженного ядра (протона) и отрицательно заряженного электрона (ов) и, в целом, атом электронейтрален.
 В 1911 английским физиком Г Э. Резерфордом была предложена «Планетарная модель атома»: атомное ядро находится в центре атома, а электроны вращаются вокруг ядра по орбитам подобно планетам, вращающимся вокруг Солнца (причем скорость движения электронов может составлять от 100 000 до 300 000 км/сек).
В 1911 английским физиком Г Э. Резерфордом была предложена «Планетарная модель атома»: атомное ядро находится в центре атома, а электроны вращаются вокруг ядра по орбитам подобно планетам, вращающимся вокруг Солнца (причем скорость движения электронов может составлять от 100 000 до 300 000 км/сек).
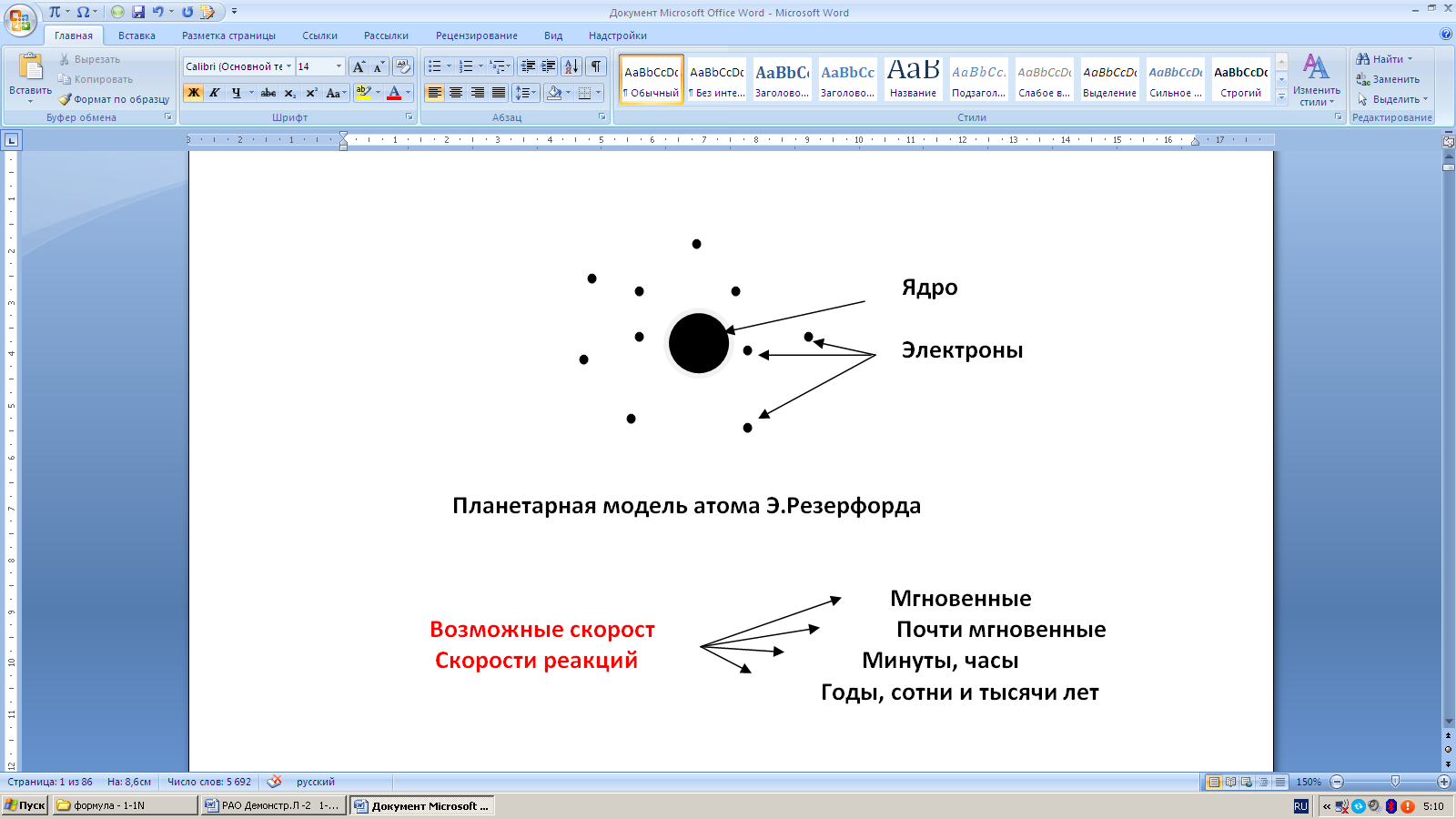
Проблема модели - по признанию Э.Резерфорда электрон, вращаясь вокруг ядра теряет энергию и должен упасть на ядро, что приведет к разру- шению атома. Однако этого не происходит. Решение этой проблемы было осуществлено в 1913 г датским физиком Н. Бором.
Н. Бор объединив ядерную модель Э. Резерфорда с квантовой теорией света (лучистая энергия испускается или поглощается телами не непреры- вно, а отдельными порциями – квантами).предложил свою теорию строения атома.
Суть теории сводится к следующему:
1. В невозбужденном «спокойном» состоянии атома электрон(ы) обраща- ются вокруг ядра атома не по любым, а только по строго определенным, «разрешенным» круговым орбитам (при этом они не излучают энергию).
2. При возбуждении атома (при получении им дополнительной энергии), длящейся лишь стомиллионные доли секунды, электрон перемещается на одну из более отдаленных от ядра орбит и тут же возвращается на исходную орбиту, при этом происходит излучение энергии в виде кванта.
В 1927 г. была предложена теория двойственности электрона: электрон
обладает свойствами как частицы (имеющую массу 9,1∙10-18г), так и волны (т.е. имеет длину волны, частоту колебаний).
В 1932 г. Д.Чедвиком (англия) в ядре атома была открыта электроней- тральная частица равной массе протона - нейтрон. Следовательно, как и атом ядро имеет сложный состав и построено из еще более мелких частиц – нуклонов (протонов и нейтронов).
Д.Д. Иваненко и В. Гейзенбергом (1932 г) была выдвинута протонно-нейтронная теория строения ядра.
Суть теории заключалась в следующем:
1. Все ядро состоит из протонов (Z) и нейтронов (N).
2. Массовое число ядра (А) есть сумма протонов и нейтронов в ядре:
А = Z + N
3. Силы, удерживающие протоны и нейтроны в ядре, называются ядерными силами.
4. В ядре сосредоточена вся масса атома.
Было установлено, что у многих химических элементов имеется несколько разновидностей атомов с одинаковым количеством протонов (а, следователь- но, и с одинаковым зарядом ядра), но разной атомной массой. Такие элеме-
нты получили название изотопы.
Записывается изотоп символом химического элемента Х с указанием слева вверху массового числа А и слева внизу числом протонов Z (зарядом ядра): 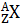 . Например, изотопы кислорода с массовым числом 16, 17, 18 и зарядом ядра 8 записываются:
. Например, изотопы кислорода с массовым числом 16, 17, 18 и зарядом ядра 8 записываются: 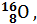
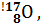
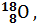 ; изотопы свинца –
; изотопы свинца – 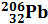 ,
, 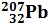 ,
, 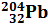 ; изотопы калия –
; изотопы калия – 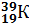 ,
, 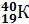 ,
, 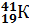 и т.п.
и т.п.
Исходя из изотопного состава одного и того же химического элемента его атомная масса определяется как средняя атомная масса его изотопов. Например, хлор является смесью двух изотопов 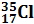 и
и 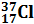 . Следовательно, его атомная масса равна 35+37:2 = 35,5 а.е.м.; у калия – 39+40+41:3 = 39,098 а.е.м. (а.е.м. – атомная единица массы).
. Следовательно, его атомная масса равна 35+37:2 = 35,5 а.е.м.; у калия – 39+40+41:3 = 39,098 а.е.м. (а.е.м. – атомная единица массы).
В настоящее время известно более 270 стабильных и более 1000 неустойчивых, радиоактивных изотопов, т.е. изотопов, распадающихся самопроизвольно (а) либо искусственным путем (б) и превращающихся в атомы одного или нескольких других химических элементов:
а) 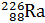
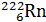 +
+ 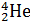
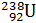
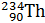 +
+ 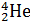
Радий Радон Гелий Уран Торий Гелий
б) 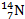 +
+ 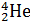 =
= 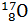 +
+ 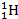 (Э.Резерфорд в 1919 г.):
(Э.Резерфорд в 1919 г.):
Осуществлена реакция превращения урана в плутоний, что привело к созданию атомной бомбы: Реакция протекала поэтапно:
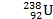 +
+ 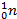 =
= 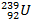
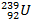 =
= 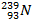 + e-
+ e- 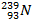 =
= 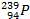 + e-
+ e-
Уран Нейтроны Уран Уран Нептуний электрон Нептуний Плутоний электрон
нестабильный нестабильный нестабильный нестабильный
После создания циклотронов, циклофазотронов, коллайдеров было осуществлено большое количество ядерных реакций и открыты новые хими- ческие элементы.
 2015-10-16
2015-10-16 695
695







