Аминокислоты, поступающие в организм в количествах, превышающих потребности, связанные с биосинтезом белков, запасаться в организме не могут и используются как метаболическое топливо.
Катаболизм аминокислот чаще всего начинается с реакции дезаминирования – удаления α-аминогруппы. Дезаминированию подвергаются все аминокислоты, кроме лизина.
Различают следующие виды дезаминирования:
а) окислительное – для Glu
б) неокислительное – для Ser, Thr, His, Cys.
в) непрямое – для всех остальных аминокислот.
Непрямое дезаминирование аминокислот протекает в 2 стадии. Первая стадия – реакция переаминирования. Реакциями переаминирования называют реакции переноса аминогруппы от аминокислоты на кетокислоту с образованием новой аминокислоты и новой кетокислоты, а ферменты, катализирующие эти реакции, получили название аминотрансфераз или трансаминаз. Основным акцептором (сборщиком) аминогрупп является 2-оксоглутарат.
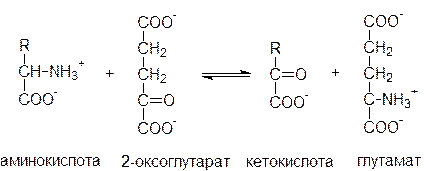
Кроме того, в роли промежуточных акцепторов аминогрупп могут выступать пируват и оксалоацетат. Образующиеся при этом, соответственно, аланин и аспартат могут передавать свою аминогруппу на 2-оксоглутарат с образованием глутамата. Таким образом, аминогруппы большинства аминокислот собираются в составе глутамата.
|
|
|
Вторая стадия: собственно дезаминирование. Реакция катализируется глутаматдегидрогеназой (ГДГ) – митохондриальным ферментом, использующим в качестве кофермента НАД+. Реакция обратима и функционирует как в процессах катаболизма, так и биосинтеза аминокислот.
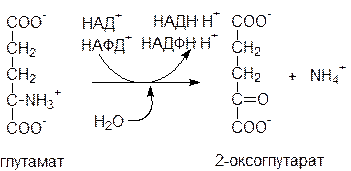
ГДГ печени является регуляторным ферментом. ГТФ и АТФ являются аллостерическими ингибиторами, тогда как ГДФ и АДФ служат аллостерическими активаторами. Следовательно, снижение энергетического заряда ускоряет окисление аминокислот.
Определение активности АлАТ в сыворотке крови широко используется в клинике с целью ранней диагностики и мониторинга заболеваний печени.
 2015-10-16
2015-10-16 1053
1053








