Вода
В фармацевтической практике используют воду очищенную, воду высокоочищенную, воду для инъекцийи воду для инъекций в ампулах. Они имеют идентичные свойства, представляют собой бесцветные прозрачные жидкости без запаха и вкуса с рН 5,0-7,0, но различаются способами приготовления и, соответственно, степенью чистоты, что отражено в фармакопейных статьях (ФС).
Воду очищенную получают дистилляцией, ионным обменом, обратным осмосом или другим способом. Ее подвергают испытаниям на чистоту в соответствии с требованиями ФС. Определение рН проводят потенциометрическим методом.
Сухой остаток не должен превышать 0,001%. Его устанавливают, выпаривая досуха 100 мл воды. Затем высушивают при 100-105°С до постоянной массы, взвешивают и рассчитывают массовую долю (%).
Испытание на восстанавливающие вещества выполняют путем кипячения в течение 10 мин смеси, состоящей из 100 мл воды, 2 мл разведенной серной кислоты и 1 мл 0,01 М свежеприготовленного раствора перманганата калия. Должно сохраниться розовое окрашивание.
Содержание диоксида углерода контролируют по отсутствию помутнения в течение 1 ч у смеси, состоящей из равных объемов испытуемой и известковой воды (насыщенный раствор гидроксида кальция), в заполненном доверху и плотно закрытом сосуде.
Отсутствие нитратов и нитритов доказывают по отрицательной реакции с 1 мл 0,5% раствора дифениламина в концентрированной серной кислоте (не должно появляться голубое окрашивание). При выполнении испытания к 5 мл воды осторожно прибавляют указанный объем реактива.
Испытание воды очищенной на хлориды, сульфаты, соли кальция и тяжелые металлы выполняют в соответствии с требованиями ГФ РК. Там же описано испытание на примесь аммиака, содержание которого допускается не более 0,00002%. Реагентом служит реактив Несслера.
Контролируют также микробиологическую чистоту. Вода очищенная должна соответствовать требованиям, предъявляемым к питьевой воде (не более 100 микроорганизмов в 1 мл и не более трех бактерий группы кишечных палочек в 1 л воды).
Воду очищенную применяют для приготовления неинъекционных лекарственных средств. Ее используют свежеприготовленной или хранят в закрытых емкостях, изготовленных из материалов, не изменяющих свойств воды и защищающих от инородных частиц и микробиологических загрязнений. В соответствии с приказом Приказом МЗ РК от 18 ноября 2009 года № 732 «Об утверждении правил проведения внутриаптечного контроля изготовленных лекарственных препаратов» вода очищенная имеет срок годности 3 суток при 25°С. Воду очищенную используют для приготовления микстур и растворов для внутреннего употребления, глазных капель и офтальмологических растворов, капель для носа, некоторых растворов наружного применения и полуфабрикатов.
Вода для инъекций должна выдерживать испытания, приведенные монографии «Вода для инъекций» (ГФ РК т.2, с.165), и быть апирогенной, не содержать антимикробных веществ и других добавок. Ее подвергают испытанию на пирогенность и на механические включения.
Воду для инъекций хранят при комнатной температуре в закрытых емкостях, изготовленных из материалов, не изменяющих свойств воды, защищающих ее от попадания механических включений и микробиологических загрязнений не более 24 ч. На этикетках емкостей для сбора и хранения должно быть обозначено, что содержимое не простерилизовано.
Вода для инъекций используется в качестве растворителя для приготовления инъекционных растворов. Для инъекционных лекарственных форм, изготавливаемых в асептических условиях и не подвергаемых последующей стерилизации применяют стерильную воду для инъекций.
Воду для инъекций в ампулах выпускают в ампулах из нейтрального стекла по 1,2, 3, 5, 10, 20 мл, которые стерилизуют при 120°С в течение 20 мин. ФС предъявляет более высокие требования к ее качеству. Вода для инъекций в ампулах не должна давать положительных реакций на хлориды, сульфаты, кальций, тяжелые металлы. Tребования к рН среды, содержанию сухого остатка, восстанавливающих веществ, диоксида углерода, нитратов и нитритов, аммиака такие же, как и для воды очищенной. Испытания на пирогенность и на наличие механических включений выполняют так же, как при испытании воды для инъекций. Кроме того устанавливают стерильность, проводят определение номинального объема и соблюдение других требований к ампулированным инъекционным растворам. Вода для инъекций в ампулах используется для тех же целей, что и вода для инъекций, но имеет срок годности четыре года.
Лекарственные препараты водорода пероксида водорода
В медицинской практике применяют раствор водорода перекиси, магния перекись и гидроперит.
По физическим свойствам различают жидкие (3%-ный раствор) и твердые (магния перекись, гидроперит) лекарственные препараты водорода перекиси.
Свойства лекарственных препаратов водорода перекиси

Гидроперит образует водорода перекись при растворении в воде.
Магния перекись выделяет водорода перекись в расворах минеральных кислот:
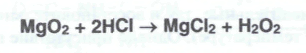
 Водорода перекись впервые получена Тенаром в 1818 г. при действии серной кислотой на бария перекись:
Водорода перекись впервые получена Тенаром в 1818 г. при действии серной кислотой на бария перекись:
Производство водорода перекиси осуществляют электролизом 40-68%-ных растворов серной кислоты при 5-8°С. Процесс электролиза проходит по схеме:

Продуктом электролиза является надсерная (пероксодисерная) кислота. При последующем нагревании раствора в вакууме (50 гПА или 38 мм рт. ст.) до 70-75°С она разлагается с образованием водорода перекиси и серной кислоты:
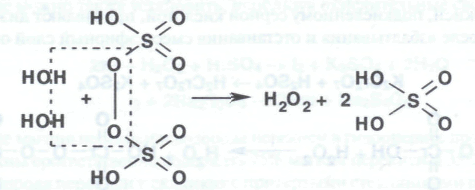
Эти способы позволяют получать разбавленные растворы водорода перекиси. Путем перегонки в вакууме при 70°С концентрируют водорода перекись, получая в результате 30-60%-ные растворы.
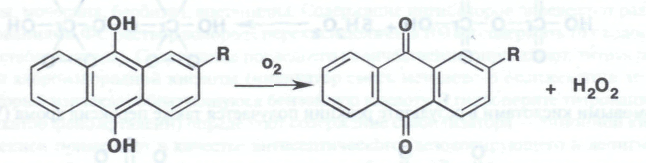 В настоящее время свыше 80% мирового промышленного производства водорода перекиси осуществляют путем автоокисления воздухом таких производных алкилантрагидрохинонов, как, например, 2-этил-, 2-трет-бутил, 2-пентилантра-гидрохинонов:
В настоящее время свыше 80% мирового промышленного производства водорода перекиси осуществляют путем автоокисления воздухом таких производных алкилантрагидрохинонов, как, например, 2-этил-, 2-трет-бутил, 2-пентилантра-гидрохинонов:
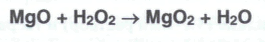 Магния перекись можно получить при взаимодействии оксида магния с водорода перекисью:
Магния перекись можно получить при взаимодействии оксида магния с водорода перекисью:
Процесс ведут при 7-8°С до образования не менее 25% магния перекиси в смеси с 75% оксида магния. Затем промывают спиртом и высушивают в вакууме (≈ 80гПА или 60 мм рт. ст.) при 45-50°С. Получить лекарственный препарат можно также электролизом 20%-ного раствора хлорида магния и раствора водорода перекиси. Магния перекись выделяется на платиновом катоде. Еще один способ получения основан на окислении оксида магния кислородом при 500°С:
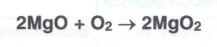
Гидроперит представляет собой сольват водорода перекиси. Его получают при взаимодействии эквимолекулярных количеств мочевины и водорода перекиси с добавлением раствора лимонной кислоты (консервант):
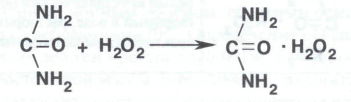
В химическом отношении водорода перекись представляет собой очень слабую кислоту. Водные растворы ее имей слабокислую реакцию, константа диссоциации 2,0 . 10-12.
Водорода перекись проявляет как окислительные, так и восстановительные свойства. Она устойчива в чистом состоянии и в водных растворах (при обычной температуре). Однако присутствие примесей солей тяжелых металлов, диоксида марганца, следов щелочей, окислителей и восстановителей, даже попадание пылинок и соприкосновение с шероховатой поверхностью резко ускоряет процесс разложения водорода перекиси и может вызвать взрыв, если растворы имеют высокую концентрацию:
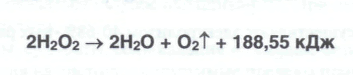
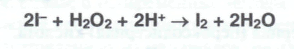 Окислительные свойства водорода перекиси используют как для подтверждения подлинности, так и количественного определения. При установлении подлинности к 2 мл раствора водорода перекиси добавляют по I мл разведенной серной кислоты и йодида калия, а затем 5 мл хлороформа. Смесь взбалтывают, после расслоения образовавшийся в результате реакции свободный йод окрашивает слой хлороформа в фиолетовый цвет:
Окислительные свойства водорода перекиси используют как для подтверждения подлинности, так и количественного определения. При установлении подлинности к 2 мл раствора водорода перекиси добавляют по I мл разведенной серной кислоты и йодида калия, а затем 5 мл хлороформа. Смесь взбалтывают, после расслоения образовавшийся в результате реакции свободный йод окрашивает слой хлороформа в фиолетовый цвет:
Для установления подлинности указанных лекарственных препаратов водорода перекиси используют реакцию образования окрашенных в синий цвет перекисных соединений (смеси надхромовых кислот и пероксида хрома), растворимых в эфире. К раствору водорода перекиси, подкисленному серной кислотой, прибавляют диэтиловый эфир и несколько капель раствора дихромата калия. После взбалтывания и отстаивания смеси эфирный слой окрашивается в синий цвет:
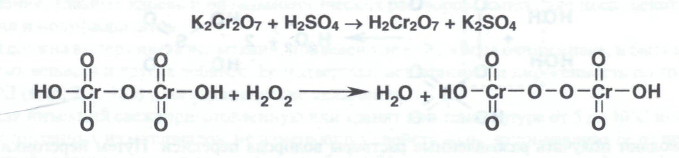
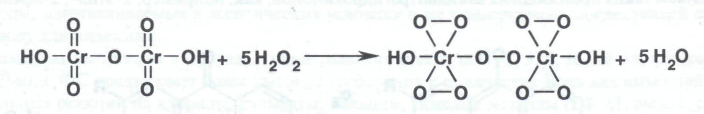 При выполнении реакции с водорода перекисью высокой концентрации образуется надхромовая кислота состав Н2Сr2O12:
При выполнении реакции с водорода перекисью высокой концентрации образуется надхромовая кислота состав Н2Сr2O12:
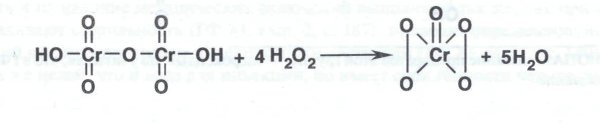 Наряду с надхромовыми кислотами в результате реакции получается также пероксид хрома (VI):
Наряду с надхромовыми кислотами в результате реакции получается также пероксид хрома (VI):
Наличие иона магния в магния перекиси подтверждают по образованию белого кристаллического осадка фосфата магния-аммония при взаимодействии с раствором гидрофосфата динатрия в присутствии хлорида аммония и аммиака:

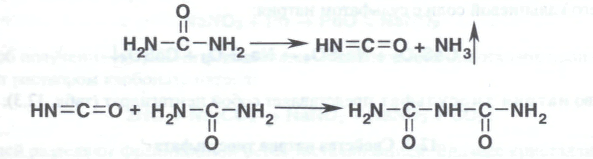 Мочевину в растворах гидроперита открывают с помощью биуретовой реакции. Это общая реакция на мочевину, амиды, имиды, полипептиды, белки. Биурет образуется при медленном нагревании мочевины до 150-160°С. Вначале получается изоциановая кислота, которая реагирует с мочевиной, образуя биурет:
Мочевину в растворах гидроперита открывают с помощью биуретовой реакции. Это общая реакция на мочевину, амиды, имиды, полипептиды, белки. Биурет образуется при медленном нагревании мочевины до 150-160°С. Вначале получается изоциановая кислота, которая реагирует с мочевиной, образуя биурет:
Взаимодействуя с солями меди (II) в щелочной среде, биурет образует растворимые внутрикомплексные соединения фиолетового цвета:
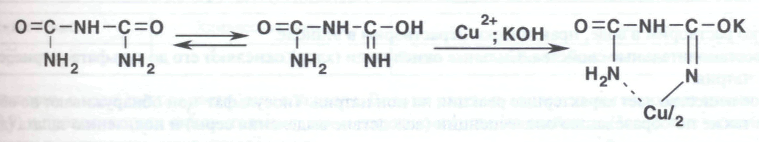
Наличие стабилизатора — цитрат-иона (лимонной кислоты) в гидроперите обнаруживают по реакции с раствором хлорида кальция. При нагревании после выделения газа выпадает осадок цитрата кальция, растворимый в хлороводородной кислоте.
Для количественной оценки твердых и жидких лекарственных препаратов используют либо восстановительные, либо окислительные свойства водорода перекиси.
 Количественное определение водорода перекиси — восстановителя выполняют прямым перманганатометрическим титрованием в кислой среде (до слабо-розового окрашивания):
Количественное определение водорода перекиси — восстановителя выполняют прямым перманганатометрическим титрованием в кислой среде (до слабо-розового окрашивания):
Лекарственный препарат должен содержать 2,5-3,5% водорода перекиси.
Количественное содержание можно также установить, используя окислительные свойства водорода перекиси, йодометрическим методом:

Количественное определение магния перекиси и водорода перекиси в гидроперите проводят прямым перманганатометрическим титрованием. Они должны соответственно содержать 25% магния перекиси и 35% водорода перекиси в гидроперите.
Хранят 3%-ный раствор водорода перекиси в склянках с притертыми стеклянными пробками, в прохладном, защищенном от света месте. Концентрированные растворы водорода перекиси взрывоопасны. Твердые препараты водорода перекиси хранят в сухом, защищенном от света месте, в хорошо укупоренной таре при комнатной температуре. В присутствии влаги магния перекись образует гидраты: Mg2О * Н2О и Mg2О *2Н2О.
Разложению водорода перекиси способствуют ферменты — каталаза, пероксидаза, содержащиеся в крови, слюне и других биологических жидкостях. Однако существует ряд ингибиторов этой реакции: фосфорная, щавелевая, лимонная, барбитуровая и мочевая кислоты, мочевина, барбитал, ацетанилид. Содержание ингибиторов определяют различными методами.
В соответствии с требованиями ФС раствор водорода перекиси должен в 100 мл содержать 10 г водорода перекиси (30%) и 0,05 г натрия бензоата (стабилизатора). Содержание последнего количественно определяют, титруя раствор водорода перекиси 0,05 М раствором хлороводородной кислоты (индикатор смесь метилового оранжевого и метиленового синего) в присутствии эфира, который извлекает образующуюся бензойную кислоту. В гидроперите титрованием 0,1 М раствором гидроксида натрия (индикатор фенолфталеин) определяют содержание стабилизатора — лимонной кислоты (0,15-0,25%).
Раствор водорода перекиси применяют в качестве антисептического, дезодорирующего и депигментирующего средства. Назначают для промываний, полосканий, предварительно разбавляя 3%-ный раствор водорода перекиси водой до 0,25%-ного. Одна таблетка гидроперита (1,5 г) соответствует 15 мл 3%-ного раствора водорода перекиси. Магния перекись применяют при желудочно-кишечных заболеваниях по 0,25-0,5 г 3-4 раза в день.
 2015-10-16
2015-10-16 8193
8193