Как уже упоминалось, термодинамика не дает ответа на вопрос что же определяет скорость химической реакции, что делает константу скорости большой или маленькой. Молекула в реакциях первого порядка вступает в реакцию только после достижения определенного энергетического состояния. Если бы все реагирующие молекулы находились в этом состоянии, реакция протекала бы мгновенно с участием всех реагирующих молекул. В действительности, в реакции обычно принимает участие только небольшая доля молекул, обладающих определенным уровнем энергии. Все это относится и к реакциям второго порядка, Низкая скорость реакций связана с тем, что не всякое взаимодействие между молекулами может приводить к реакции из-за энергетических возможностей или из-за неправильной ориентации между взаимодействующими молекулами.
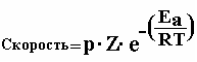
Простое уравнение кинетики химической реакции показывает, что скорость реакции зависит от Z- частоты столкновений, р – вероятностного фактора, определяющего пространственную ориентацию реагирующих веществ и Ea – энергии активации. Для вступления в реакцию молекула должна обладать определенным количеством энергии. Выражение е-(Еа/RT) показывает долю молекул, обладающую энергией Еа при температуре Т. Чем выше значение Еа, тем меньше становится количество молекул, способных преодолеть этот барьер. Чтобы реакция протекала быстрее необходимо повысить значение р, Z и снизить значение Еа.
|
|
|
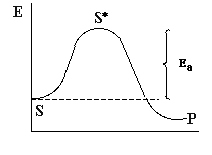 Подобного рода рассуждения привели к идее энергетического барьера реакции и понятию «активное или переходное состояние».
Подобного рода рассуждения привели к идее энергетического барьера реакции и понятию «активное или переходное состояние». 
Рисунок слева изображает график изменений свободной энергии системы относительно координат реакции для химической реакции, подчеркивая прохождение реакции через промежуточное состояние S*. Это довольно упрощенное изображение показывает, что свободная энергия стандартного состояния продуктов более низкая, чем свободная энергия реагентов. Все реакции имеют энергетический "барьер". В активированное или переходное состояние молекулы переходят в том случае, если они приобретает энергию, достаточную для участия в реакции. Если мы предположим что [S*] представляет концентрацию молекул, имеющих энергию активации из общего количества молекул [S]0, то мы можем записать уравнение константы равновесия K как [S*] /[S]0. Значение этой константы не дает нам представления ни о высоте барьера, ни о скорости реакции.
 Если барьер реакции высок, только небольшая часть молекул будет иметь достаточно энергии для участия в реакции. Поскольку только молекулы в переходном состоянии могут вступать в реакцию (в любом направлении), константа скорости прямой и обратной реакций пропорциональна совокупности молекул находящихся в переходном состоянии.
Если барьер реакции высок, только небольшая часть молекул будет иметь достаточно энергии для участия в реакции. Поскольку только молекулы в переходном состоянии могут вступать в реакцию (в любом направлении), константа скорости прямой и обратной реакций пропорциональна совокупности молекул находящихся в переходном состоянии.
|
|
|
Как понизить энергетический барьер реакции?
Это можно достигнуть несколькими путями:
- Повысить температуру, увеличив тем самым и количество столкновений, и число молекул, обладающих достаточной энергией. К этому приему часто прибегают химики, но в биологических процессах этот прием использовать нельзя
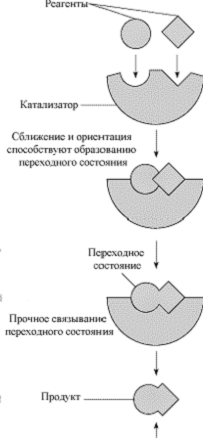
- Использовать катализатор – специальное вещество, которое характеризуются способностью, принимая участие в реакции, обеспечивать ускорение реакции, выходить из реакции, не изменяясь, что позволяет им многократно участвовать в реакции. Катализатор позволяет сблизить реагирующие вещества и создать условия для их оптимальной ориентации, необходимой для проведения реакции, что способствует увеличению эффективной концентрации участников реакции (гетерогенный катализ). Катализаторы могут прочно фиксировать промежуточную конформацию реагентов, соответствующую переходному состоянию но с более низким энергетическим барьером. Позиция равновесия (количество продукта относительно реагента) не изменяется катализатором. Даже, если значения констант скорости прямой и обратной реакций k1 и k-1 могут быть сильно изменены от их значений при отсутствии катализатора, каждое из них изменяется на один тот же коэффициент и константа равновесия K не изменяется, потому что K = k1/k-1.
 2015-10-16
2015-10-16 1602
1602








