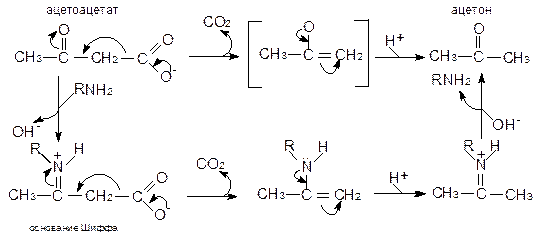
 Сопряженный кислотный и общий основной катализ: катализ реакции с одновременным участием функциональных групп, обладающих свойствами слабой кислоты и слабого основания. Пространственная структура фермента позволяет расположить кислые или основные группы в ограниченном объеме в непосредственной близости к субстрату. Если расположить хотя бы одну группу-донор H+ в маленьком объеме, это обеспечивает высокую концентрацию протонов, не влияя на общее значение pH окружающей среды.
Сопряженный кислотный и общий основной катализ: катализ реакции с одновременным участием функциональных групп, обладающих свойствами слабой кислоты и слабого основания. Пространственная структура фермента позволяет расположить кислые или основные группы в ограниченном объеме в непосредственной близости к субстрату. Если расположить хотя бы одну группу-донор H+ в маленьком объеме, это обеспечивает высокую концентрацию протонов, не влияя на общее значение pH окружающей среды.
Ковалентный катализ Это ускорение скорости путем промежуточного образования ковалентной связи между катализатором и субстратом. Декарбоксилирование ацетоацетата катализируемое первичными аминами - пример такого процесса. В первую стадию этого процесса амин нуклеофильно атакует карбонильную группу ацетоацетата с образованием Шиффова основания. И образующийся ковалентный интермедиат снижает высокоэнергетический енольный характер переходного состояния.
Ковалентный катализ включает три стадии:
|
|
|
1.Нуклеофильная реакция между катализитором и субстратом с образованием ковалентной связи
2.Перемещение электронов от центра реакции теперь уже электрофильным катализатором
3.Реакция обратная 1 с удалением катализатора.
 Ковалентный тип катализа один из популярных типов в реакциях катализируемых ферментами.
Ковалентный тип катализа один из популярных типов в реакциях катализируемых ферментами.
Катализ с участием ионов металлов. Значительная часть ферментов катализируют реакции в присутствии ионов металлов. Ионы металлов участвуют в катализе тремя путями
1. связываются с субстратами, ориентируя их нужным образом для реакции
2. опосредуют окислительно-восстановительные реакции путем обратимых изменений своего состояния
3. электростатически стабилизируют отрицательные заряды.
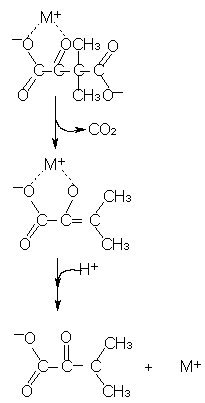
В некоторых реакциях ионы металлов действуют подобно протонам, нейтрализуя отрицательные заряды, причем ионы металлов более эффективны, чем протоны, потому что они присутствуют в более высоких концентрациях при нейтральных рН и имеют заряд 1. Декарбоксилирование диметилоксалоацета катализируется такими металлами как медь или никель и является примером катализа при участии ионов металлов.
Ионы металлов могут ускорять нуклеофильный катализ путем ионизации воды, а также экранировать заряды молекул, облегчая задачу нуклеофилов в проведении реакции.
Электростатический катализ. При взаимодействии с ферментом субстрат вытесняет воду из активного центра и процессы, протекающие в таком случае напоминают процессы протекающие в органическом растворителе, где электростатические взаимодействия проявляют себя более сильно, чем в водной среде. Изменение распределения зарядов при низких диэлектрических константах может оказывать влияние на реактивность химических групп. Хотя экспериментальные доказательства и теоретический анализ этого механизма остается предметом исследований, существует предположение, что распределение зарядов в активном центре фермента направлено на стабилизацию переходного состояния катализируемой реакции. Такой способ повышения скорости, который соответствует форме катализа с участием ионов металлов, описанный выше называют электростатическим катализом.
|
|
|
 2015-10-16
2015-10-16 513
513








