Для ответа на вопрос следует вычислить ΔG 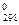 прямой реакции. Значения ΔG
прямой реакции. Значения ΔG 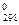 соответствующих веществ даны в табл. 4. Зная, что ΔG
соответствующих веществ даны в табл. 4. Зная, что ΔG 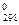 есть функция состояния и что ΔG
есть функция состояния и что ΔG 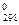 для простых веществ, находящихся в агрегатных состояниях, устойчивых при стандартных условиях, равны нулю, находим ΔG
для простых веществ, находящихся в агрегатных состояниях, устойчивых при стандартных условиях, равны нулю, находим ΔG 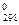 процесса:
процесса:
ΔG 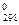 = (2∙ΔG
= (2∙ΔG 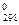 (CO) + 2∙ΔG
(CO) + 2∙ΔG 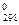 (H2)) – (ΔG
(H2)) – (ΔG 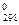 (CH4) + ΔG
(CH4) + ΔG 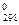 (CO2)) =.
(CO2)) =.
= (2(-137,27) + 2(0)) – (- 50,79 – 394,38) = +170,63 кДж.
То, что ΔG 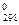 > 0, указывает на невозможность самопроизвольного протекания прямой реакции при Т = 298 К и равенстве давлений взятых газов 101,325 кПа.
> 0, указывает на невозможность самопроизвольного протекания прямой реакции при Т = 298 К и равенстве давлений взятых газов 101,325 кПа.
Пример 3. На основании стандартных теплот образования (табл. 4) и абсолютных стандартных энтропий веществ (табл. 4) вычислите ΔG 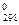 реакции, протекающей по уравнению:
реакции, протекающей по уравнению:
СО(г) + Н2О(ж) = СО2(г) + Н2(г).
 2015-10-14
2015-10-14 364
364








