Реакция омыления сложного эфира в щелочном растворе протекает по уравнению:
CH3COOC2H5 + NaOH ® CH3COONa + C2H5OH (95)
с образованием спирта и соли органической кислоты.
В разбавленном водном растворе реакция протекает бимолекулярно и практически до конца. Изменение концентрации реагирующих веществ может быть определено по значению электропроводности раствора.
В процессе реакции ионы гидроксила заменяются анионами соли. Подвижности последних значительно меньше, чем у ионов гидроксила, в результате чего электропроводность раствора по мере прохождения реакции уменьшается.
Удельная электропроводность раствора (k), обозначаемая буквой «каппа» – величина, обратная удельному сопротивлению раствора (R уд):
 . (96)
. (96)
Так как удельное сопротивление выражают в Ом× см, то удельную электропроводность – в Ом-1×см-1.
В СИ для удельной электропроводности введена единица –
См×см-1 (сименс на сантиметр). В основных единицах СИ
См º м-2×кг-1×с3×А2.
Ленц ввел величину – эквивалентная электропроводность (l):
 , (97)
, (97)
где  – молярная концентрация эквивалента вещества в растворе, моль/дм3.
– молярная концентрация эквивалента вещества в растворе, моль/дм3.
Следовательно, l выражают в см2×Ом-1×моль-1 или в См×см2×моль-1.
Электропроводность растворов сильных электролитов обусловлена движением ионов, поэтому введена величина – эквивалентная электропроводность или подвижность ионов.
Согласно теории Дебая-Онзагера, подвижность одновалентных ионов в разбавленных водных растворах может быть связана с суммарной молярной концентрацией всех ионов в растворе уравнением:
 , (98)
, (98)
где  – подвижность иона при бесконечном разбавлении, См×см2×моль-1;
– подвижность иона при бесконечном разбавлении, См×см2×моль-1;
 – суммарная молярная концентрация всех ионов в растворе, моль/дм3.
– суммарная молярная концентрация всех ионов в растворе, моль/дм3.
Коэффициент А учитывает замедление движения ионов под действием электрического поля за счет движущихся навстречу противоположно заряженных ионов:
 , (99)
, (99)
где z – заряд иона;
e o = 1.602×10-16 Кл (А×с) – элементарный заряд;
NA = 6.022×1023 моль-1 – постоянная Авогадро;
h – вязкость воды, Па×с (м-1×кг×с-1);
e о = 8.854×10-12 Ф/м (Ф º м-2×кг-1×с4×А2) – диэлектрическая проницаемость вакуума;
e – диэлектрическая проницаемость воды;
k = 1.381×10-23 Дж/К (м2×кг×с-2×K-1);
Т – температура, К.
Подставив все постоянные значения в уравнение (99), получаем выражение для А:
 , См×м2×моль-1/(моль/ дм3)1/2. (100)
, См×м2×моль-1/(моль/ дм3)1/2. (100)
которое в условиях эксперимента, устанавливает зависимость А только от диэлектрической проницаемости растворителя – воды, вязкости воды и абсолютной температуры.
Внимание! В таблице 8.1 подвижность иона выражена в См×см2×моль-1, поэтому и значение коэффициента А необходимо выразить в См×см2×моль-1/(моль/ дм3)1/2.
При температуре 25 °С А = 60.4 См×см2×моль-1/(моль/ дм3)1/2.
Согласно закону Кольрауша о независимости движения ионов в разбавленном растворе (закону аддитивности эквивалентной электропроводности при бесконечном разбавлении) эквивалентная электропроводность электролитов в растворе равна сумме подвижностей ионов:
 . (101)
. (101)
Современные кондуктометры позволяют измерить удельную электропроводность раствора (k, См/см), которая связана с эквивалентной, обусловленной несколькими ионами, уравнением:
 , (102)
, (102)
где ci – молярная концентрация i -того иона, моль/дм3;
l i – подвижность иона, См×см2×моль-1.
В исследуемой системе присутствуют ионы: Na+, OH-, CH3COO-.
Обозначим:
а – исходная молярная концентрация гидроксида натрия в исследуемой системе, моль/дм3;
b – исходная молярная концентрация сложного эфира в исследуемой системе, моль/дм3;
x – молярная концентрация ацетата натрия в момент времени t, моль/дм3.
Тогда молярные концентрации ионов равны:
с (Na+) = а, с (OH-) = а-х, с (CH3COO-) = х, (103)
 , (104)
, (104)
где С – суммарная молярная концентрация всех ионов в растворе, моль/дм3.
Из уравнений (101, 102) следует:
Для начала реакции (t = 0):
 (105)
(105)
В момент времени t:

Решая систему уравнений (105, 106) получим:
 (107)
(107)
Внимание!  – удельную электропроводность раствора в начальный и промежуточный момент времени выражают в См×см-1;
– удельную электропроводность раствора в начальный и промежуточный момент времени выражают в См×см-1;
 – подвижность ионов выражают в См×см2×моль-1.
– подвижность ионов выражают в См×см2×моль-1.
В таблице 8.1 приведены значения подвижностей ионов при температуре Т = 25 °С.
Подвижность ионов при другой температуре рассчитывают по формуле:
 , (108)
, (108)
где b – коэффициент, зависящий от природы иона (таблица 8.1).
Таблица 8.1– Подвижности ионов при температуре Т = 25 °С
| Ион | Подвижность ионов | Коэффициент |
 , См×см2×моль-1 , См×см2×моль-1
| b | |
| Na+ | 50.1 | 0.0024 |
| OH- | 198.3 | 0.0180 |
| HCOO- | 54.6 | 0,0200 |
| CH3COO- | 40.9 | 0.0206 |
| CH3CH2COO- | 32.6 | 0.0200 |
| CH3CH2CH2COO- | 35.8 | 0.0200 |
В соответствии с принятыми обозначениями уравнение для константы скорости реакции второго порядка при условии 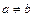 имеет вид:
имеет вид:
 . (109)
. (109)
Выполнение измерений
 2015-10-22
2015-10-22 817
817








