Электрохимические методы исследования основаны на изучении процессов, протекающих на поверхности электрода или в электродном пространстве электролитической ячейки.
Любой электрический параметр, например потенциал, сила тока, сопротивление, функционально связанный с концентрацией анализируемого вещества, может служить аналитическим сигналом, если они измерены с достаточной точностью.
При отсутствии электрического тока в замкнутой гальванической цепи на межфазной границе устанавливается равновесие, потенциал достигает равновесного значения. Если через ячейку проходит электрический ток, то на границе раздела фаз протекают химиче-ские реакции, сопровождающиеся окислением или восстановлением компонентов системы.
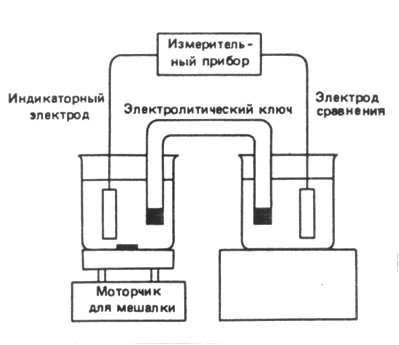
В состав электролитической ячейки входят два электрода – индикаторный, или рабочий, электрод и электрод сравнения.
Электрод, используемый как датчик, является индикаторным. Индикаторный электрод должен быстро и обратимо реагировать на изменение концентрации определяемого иона. Электрод сравнения служит для создания измерительной цепи и определения потенциала рабочего или индикаторного электрода.
|
|
|
На практике обычно и индикаторный электрод, и электрод сравнения погружают в анализируемый раствор. Иногда оба электрода размещают в одном корпусе. В этом случае их помещают в стеклянный цилиндр, заполненный раствором электролита, который отделен от анализируемого раствора диафрагмой.
На рис. показана установка для потенциометрических определений.
В качестве электродов сравнения чаще всего используют каломельный (Е0 = 0,2241 эВ) и хлоридсеребряный (Е0 = 0,198 эВ) электроды
Для определения рН растворов в качестве индикаторных электродов используют водородный либо стеклянный электрод. В стеклянном электроде, как и в хлоридсеребряном, имеется серебряная проволока, покрытая хлоридом серебра и погруженная в раствор 0,1 М соляной кислоты. Электрод отделен от измерительной системы стеклянной мембраной, проницаемой только для ионов водорода. Если рН раствора выше рН электрода, то ионы водорода переходят в раствор, заряжая электролит внутри мембраны отрицательно, а вне мембраны – положительно. Избыток отрицательного заряда электролита вызывает сдвиг равновесия полуреакции, при этом анионы хлора связываются с металлическим серебром в хлорид серебра, сообщая электроду избыточный отрицательный заряд. Таким образом, потенциал стеклянного электрода пропорционален рН раствора.
 2017-10-25
2017-10-25 2222
2222








