Супероксиддисмутаза
Супероксиддисмутаза (СОД) — важнейший энзим антирадикальной защиты. Фермент обнаружен во всех аэробных организмах. В организме млекопитающих идентифицировано две изоформы СОД: Mn-СОД (СОД2), локализованная в митохондриальном матриксе, и Cu2+/Zn+ -СОД двух типов, находящейся либо внутри клеток (в цитозоле и межмембранном пространстве митохондрий) в виде димера (СОД1), либо во внеклеточной жидкости (СОД3) в виде тетрамера. СОД на три-четыре порядка ускоряет реакцию диспропорционирования О2∙- (супероксидных анионов).
Реакция дисмутации с участием Cu,Zn-СОД идёт в две стадии, в ходе которых происходит перенос электронов с одного супероксидного анион-радикала на другой. Промежуточным акцептором этого электрона служит атом меди.
E- Cu2+ + О2∙- + H+® E-Cu+ + O2
E- Cu2+ + О2∙- + H+®E-Cu+ + H2O2
Супероксиддисмутазы обладают узкой субстратной специфичностью, действие их направлено только на полувосстановленную молекулу кислорода.
СОД может взаимодействовать также с пероксидом водорода и выступать в качестве прооксиданта, инициируя образование радикалов - супероксида и гидроксила:
|
|
|
Cu2+ -СОД + Н2О2® Сu+ -СОД + О2 ∙- + 2Н+;
Cu+ -СОД + Н2О2® Сu2+ -СОД + ОН-+ ·НО
Неорганические перекиси ингибируют СОД, необратимо восстанавливая медь в составе её активного центра. В отличие от неорганических липидные перекиси обратимо ингибируют СОД. Эффективным ингибитором фермента является гидроперекись линоленовой кислоты, снижающая её активность в 3,5 раза.
Супероксиддисмутаза играет важную роль в защите клеток от повреждающего действия супероксидного анион-радикала и по праву считается главным ферментом внутриклеточной АОС. СОД не только стабилизирует клеточные мембраны, предотвращая процессы перекисного окисления липидов. Снижая уровень О2∙-, она защищает от его дезактивирующего действия каталазу и глутатионпероксидазу.
Регулирующее влияние на активность СОД оказывают глутатион, цистеин, другие SH-содержащие соединения, а также опосредованно ферменты глутатионового обмена; последние, наряду с каталазой и пероксидазами различной субстратной специфичности, обеспечивают детоксикацию пероксида водорода.
Издержками этого ферментативного процесса является образование перекиси водорода, способной образовывать высокореакционные гидроксильные радикалы, но восстанавливаемая до воды в основном каталазой и глутатионпероксидазой.
Каталаза
Каталаза – хромопротеин с молекулярной массой около 240 кДа, состоит из 4 субъединиц, имеющих по одной группе гема, локализуется в основном в пероксисомах, частично – в микросомах и в меньшей мере – в цитозоле. Полагают, что каталаза не имеет высокого сродства к перекиси водорода и не может эффективно обезвреживать это соединение при низких концентрациях, имеющихся в цитозоле. В пероксисомах, где концентрация перекиси водорода высока, каталаза активно разрушает ее.
|
|
|
Разложение перекиси водорода каталазой осуществляется в два этапа:
Fe3+-каталаза + 2 H2O2→ окисленная каталаза + H2O2→ Fe3+-каталаза + H2O2+ O2
При этом в окисленном состоянии каталаза работает как пероксидаза. Субстратами в пероксидазной реакции могут быть этанол, метанол, формиат, формальдегид и другие доноры водорода.
Следует отметить, что около 0,5% кислорода, образующегося в результате разложения перекиси водорода, возникает в возбужденном, синглетном состоянии и таким образом в процессе разложения перекиси водорода вновь генерируются активные формы кислорода.
Каталаза в клетках, в частности, в эритроцитах, находится в едином комплексе с СОД, поэтому совместное действие этих антиоксидантных ферментов может быть представлено в виде единой реакции:

 O2-∙+ 2H+ СОД H2O2 каталазаН2О +О2
O2-∙+ 2H+ СОД H2O2 каталазаН2О +О2
Таким образом, совместное действие СОД и каталазы обеспечивает надежную защиту организма от токсического действия высоких концентраций супероксидного анион-радикала и перекиси водорода, но, в то же время, поддерживает минимальный (ниже 50,0 мкМ) контролируемый уровень этих соединений необходимых в физиологических условиях для осуществления многих клеточных процессов. В случае необходимости изменение активности одного из ферментов может резко изменить и уровень перекиси водорода. Так, например, при стимуляции фагоцитоза резко возрастает активность СОД, что приводит к образованию повышенных количеств перекиси водорода, которая используется для создания самых мощных деструктивных факторов фагоцитоза – гидроксильного радикала и гипохлорит-иона.
Глутатионпероксидаза
Глутатионпероксидаза (ГПО) -важнейший фермент, обеспечивающий инактивацию активных форм кислорода, так как разрушает и пероксид водорода и гидропероксиды липидов. Он катализирует восстановление пероксидов с помощью трипептида глутатиона (γ-глутамилцистеинилглицин). ГПО – гомотетрамерный селенопротеин, имеет молекулярную массу около 74 кДа, состоит из 4 идентичных субъединиц, в состав активного центра входит селен, который содержится в виде Se-цистеина. Селен необходим для синтеза глутатионпероксидазы.

Рис.9. Структурная формула глутатиона
Сульфгидрильная группа глутатиона (GSH) служит донором электронов и, окисляясь, образует дисульфидную форму глутатиона, в которой 2 молекулы глутатиона связаны через дисульфидную группу. Ген глутатионпероксидазы локализован в 3-й хромосоме. Глутатионпероксидаза катализирует реакции, в которых фермент восстанавливает пероксид водорода до воды, а также восстановление органических гидропероксидов (ROOH) до гидроксипроизводных, и в результате переходит в окисленную дисульфидную форму GS-SG:
2GSH + H2O2®GSSG + H2O
2GSH + ROOH®GSSG + ROH +H2O
Окисленный глутатион (GSSG) восстанавливается в глутатионредуктазной реакции с участием NADPH.
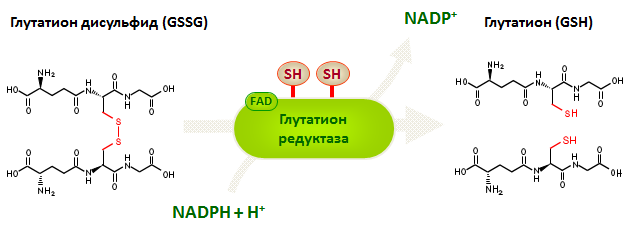
Рис. 10. Схема восстановления окисленного глутатиона.
Глутатионпероксидаза обезвреживает не только H2O2, но и разные органические липидные пероксилы, которые образуются в организме при активации ПОЛ. Такие как гидропероксиды линолевой и линоленовой кислот, холестерин-7β-гидропероксид и некоторые синтетические вещества (кумен-, трет-бутил-гидропероксиды). Глутатионпероксидаза защищает от окислительной атаки белки, липиды, никотинамидные коферменты, восстанавливает липидные перекиси.
Помимо способности восстанавливать пероксид водорода и гидропероксиды жирных кислот, ГОП обеспечиваетзащиту аэробных организмов и от чрезвычайно токсичного пероксинитритапутем восстановления его до нитрит-аниона:
|
|
|
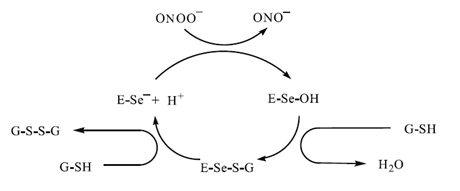
Рис. 11. Предполагаемый каталитический механизм восстановления пероксинитрита глутатионпероксидазой.
Фермент глутатионпероксидаза локализирован в цитозоле в небольших количествах, а также в митохондриях. В тканях млекопитающих максимальная активность глутатионпероксидазы в печени, эритроцитах, надпочечниках. Активность фермента зависит от количества образованных пероксидов. Функционирует сопряженно сглутатионредуктазой.
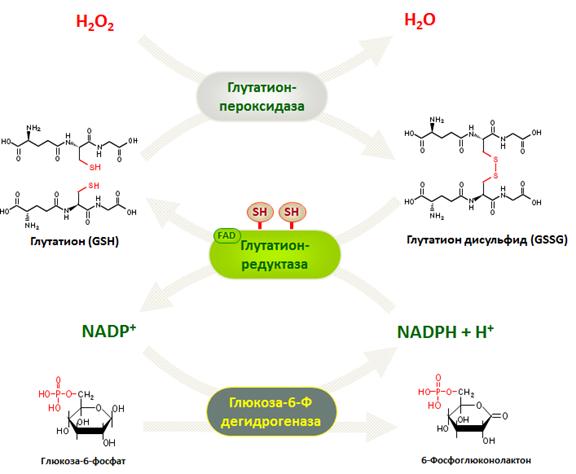
Рис.12. Схема механизма работы глутатион-редокс системы.
Главной ферментативной системой плазмы крови является ГПО внеклеточных жидкостей и ГПО гидроперекисей липидов (ГПО 4), которая будучи липофильным соединением эффективно взаимодействует с гидроперекисями фосфатидилхолина, холестерина и эфиров холестерина в липопротеинах низкой плотности, восстанавливая их, следовательно, защищая от окислительной модификации. Кроме того, ГПО 4 совместно с токоферолом практически полностью подавляет ПОЛ в биологических мембранах благодаря тому, что витамин Е эффективно восстанавливает пероксирадикалы, а фермент разлагает гидроперекиси, препятствуя тем самым их вовлечению в окислительный цикл.
 2017-11-30
2017-11-30 2490
2490








