Эквивалент – это реальная или условная частица, которая в кислотно-основных реакциях присоединяет (или отдает) один ион Н+ или ОН–, в окислительно-восстановительных реакциях принимает (или отдает) один электрон, реагирует с одним атомом водорода или с одним эквивалентом другого вещества
Эсоли=1/|Zkat||Zan|
Эгидроксид=1/n(ОН)
Эоксида=1/|ст.ок.||кол. ат. элемента|
Молярная масса эквивалента (МЭ) – это масса одного моль эквивалента. Она равна произведению молярной массы вещества на фактор эквивалентности:
| МЭ = МfЭ. |
эквивалентный объем газа, представляет собой отношение объема порции данного газа к эквивалентному количеству вещества в этой порции
Молярная масса эквивалента сложного вещества равна сумме молярных масс эквивалентов образующих его составных частей, например:
М Э(оксида) = М Э(элемента) + М Э(О) = М Э(элемента) + 8
М Э(кислоты) = М Э(Н) + М Э(кислотного остатка) = 1 + М Э(кислотного остатка)
М Э(основания) = М Э(Ме) + М Э(ОН) = М Э(Ме) + 17
М Э(соли) = М Э(Ме) + М Э(кислотного остатка).
Для любых двух веществ, связанных законом эквивалентов, можно записать:
 или или 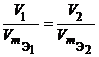 или или  , ,
|
Строение атома. Ядро и электроны, протоны и нейтроны, их заряд и масса. Квантовый характер излучения и поглощения энергии. Уравнение Планка. Представление об атомных спектрах.
При химических реакциях ядра атомов остаются без изменений, изменяется лишь строение электронных оболочек вследствие перераспределения электронов между атомами. Способностью атомов отдавать или присоединять электроны определяются его химические свойства. Заряд ядра равен Ze, где e – заряд протона, Z– зарядовое число, равное порядковому номеру химического элемента Масса ядра измеряется в атомных единицах массы (а.е.м). За одну атомную единицу массы принимается 1/12 часть массы нейтрального атома углерода 12 С
Электрон имеет двойственную (корпускулярно-волновую) природу. Благодаря волновым свойствам электроны в атоме могут иметь только строго определенные значения энергии, которые зависят от расстояния до ядра. Электроны, обладающие близкими значениями энергии образуют энергетический уровень. Он содержит строго определенное число электронов - максимально 2n2. Энергетические уровни подразделяются на s-, p-, d- и f- подуровни; их число равно номеру уровня.  кг [1] — масса электрона.
кг [1] — масса электрона.  Кл [1] — заряд электрона.Нейтрон — элементарная частица, не имеющая электрического заряда. Нейтрон является фермионом и принадлежит к классу барионов. Атомные ядра состоят из нейтронов и протонов. Нейтрон (n) – нейтральная частица с массой покоя mn = 1,675·10–27кг = 1839 me, нулевой заряд.
Кл [1] — заряд электрона.Нейтрон — элементарная частица, не имеющая электрического заряда. Нейтрон является фермионом и принадлежит к классу барионов. Атомные ядра состоят из нейтронов и протонов. Нейтрон (n) – нейтральная частица с массой покоя mn = 1,675·10–27кг = 1839 me, нулевой заряд.
Протоны (вместе с нейтронами) являются основными составляющими атомных ядер. Порядковый номер химического элемента в периодической таблице (и, соответственно, все его химические свойства) полностью определяются зарядом ядра его атомов, который, в свою очередь, равен количеству протонов в ядре (протонному числу). Протон имеет положительный заряд е+=1,06·10–19 Кл и массу покоя mp = 1,673·10–27кг = 1836 me
Квантовый характер излучения и поглощения энергии электромагнитного поля был постулирован М. Планком в 1900 году для объяснения свойств теплового излучения
уравнение Планка: E=hv (h-постоянная планка =6,62 на 10 в минус 34
АТОМНЫЕ СПЕКТРЫ - оптические спектры свободных или слабо связанных атомов (одноатомных газов, паров). Обусловлены квантовыми переходами атома. Атомные спектры - линейчатые, состоят из отдельных спектральных линий, которые характеризуются определенной длиной волны и для простых атомов группируются в спектральные серии. Содержат информацию о строении атомов, используются также в спектральном анализе.
Корпускулярно-волновая природа движущихся микрочастиц. Уравнение де Бройля. Принцип неопределенности. Понятие о волновой функции и атомной орбитали. Квантовые числа электронов в атоме.
Корпускуля́рно-волново́й дуализм — принцип, согласно которому любой объект может проявлять как волновые, так и корпускулярные свойства. Был введён при разработке квантовой механики для интерпретации явлений, наблюдаемых в микромире, с точки зрения классических концепций. Дальнейшим развитием принципа корпускулярно-волнового дуализма стала концепция квантованных полей в квантовой теории поля.
уравнение бройля: λ=h/(mv) λ=h/p
принцип неопределенности: 
dxdp  h/2
h/2 
dx-полоса неопределённости; dp – погрешность определения импульса микрочастицы
невозможно одновременно с лостаточной точностью определить местоположение движущей микрочастицы и её начальную характеристику.
волновая функция - необходимость вероятностного подхода к описанию микрообъектов является важнейшей особенностью квантовой теории. В квантовой механике для характеристики состояний объектов в микромире вводится понятие волновой функции Ψ (пси-функции). Квадрат модуля волновой функции |Ψ|2 пропорционален вероятности нахождения микрочастицы в единичном объеме пространства. Конкретный вид волновой функции определяется внешними условиями, в которых находится микрочастица. Математический аппарат квантовой механики позволяет находить волновую функцию частицы, находящейся в заданных силовых полях. Безграничная монохроматическая волна де Бройля есть волновая функция свободной частицы, на которую не действуют никакие силовые поля.
Атомная орбиталь — одноэлектронная волновая функция в сферически симметричном электрическом поле атомного ядра, задающаяся главным n, орбитальным l и магнитным m квантовыми числами.
8. Распределение электронов в атоме по энергетическим уровням, подуровням, орбиталям и квантовым ячейкам. Принцип Паули, правило Хунда, принцип минимума энергии и правила Клечковского. Электронные формулы атомов элементов (Z<56).
Главное квантовое число (n). Определяет энергетический уровень электрона, удаленность уровня от ядра, размер электронного облака. Принимает целые значения (n = 1, 2, 3...) и соответствует номеру периода. Из периодической системы для любого элемента по номеру периода можно определить число энергетических уровней атома и какой энергетический уровень является внешним.
Орбитальное квантовое число (l) характеризует геометрическую форму орбитали. Принимает значение целых чисел от 0 до (n - 1). Независимо от номера энергетического уровня, каждому значению орбитального квантового числа соответствует орбиталь особой формы. Набор орбиталей с одинаковыми значениями n называется энергетическим уровнем, c одинаковыми n и l - подуровнем. Принцип Паули. В атоме не может быть двух электронов, у которых значения всех квантовых чисел (n, l, m, s) были бы одинаковы, т.е. на каждой орбитали может находиться не более двух электронов (c противоположными спинами). Правило Хунда - Атом в основном состоянии должен иметь максимально возможное число неспаренных электронов в пределах определенного подуровня.
Электроны распределены по различным атомным орбиталям. Для схематического изображения электронных конфигураций применяются квантовые ячейки Хунда.
Принцип минимума энергии определяет порядок заселения атомных орбиталей, имеющих различные энергии. Согласно принципу минимума энергии, электроны занимают в первую очередь орбитали, имеющие наименьшую энергию. Энергия подуровней растет в ряду:1 s < 2 s < 2 p < 3 s < 3 p < 4 s < 3 d < 4 p < 5 s < 4 d < 5 p < 6 s < 4 f 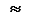 5 d < 6 p < 7 s < 5 f
5 d < 6 p < 7 s < 5 f 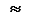 6 d...
6 d...
правило клечевского - Заполнение электронами орбиталей в атоме происходит в порядке возрастания суммы главного и орбитального квантовых чисел  . При одинаковой сумме раньше заполняется орбиталь с меньшим значением
. При одинаковой сумме раньше заполняется орбиталь с меньшим значением  .
.
 2017-11-30
2017-11-30 1412
1412








