Класс
Задача 11 - 1 (6 баллав). При взаимодействии 25,5 г предельной однооснóвной карбоновой кислоты с избытком раствора гидрокарбоната натрия выделилось 5,6 л (н.у.) газа. Определите молекулярную формулу кислоты.
Задача 11 -1 Решение. (6 баллав). 1. Cоставлено уравнение реакции в общем виде, и вычислено количество вещества газа: СnH2n+1COOH + NaHCO3 = СnH2n+1COONa + H2O + CO2
n(CO2) = 5,6: 22,4 = 0,25 моль (2 балла). 2. Рассчитана молярная масса кислоты: n(CO2) = n(СnH2n+1COOH) = 0,25 моль; М(СnH2n+1COOH) = 25,5/0,25 = 102 г/моль (2 балла)
3. Установлена молекулярная формула кислоты: М(СnH2n+1COOH) = 12n + 2n + 1 + 45 = 102; 14n + 46 = 102; 14n = 56; n = 4; Молекулярная формула – C4H9COOH (2 балла).
Задача 11 -2 ( 4 балла). Железо растворили в горячей концентрированной серной кислоте. Полученную соль обработали избытком раствора гидроксида натрия. Выпавший бурый осадок отфильтровали и прокалили. Полученное вещество сплавили с железом. Напишите уравнения четырёх описанных реакций.
Задача 11 -2 ( 4 балла). Решение. Написаны четыре уравнения описанных реакций:
1) 2Fe + 6H2SO4 →t ° Fe2(SO4)3 + 3SO2 + 6H2O (1 балл)
2) Fe2(SO4)3 + 6NaOH = 2Fe(OH)3 + 3Na2SO4 (1 балл)
3) 2Fe(OH)3 →t ° Fe2O3 + 3H2O (1 балл)
4) Fe2O3 + Fe = 3FeO (1 балл)
Задача 11 – 3 (7 баллов). Ученик слил растворы хлорида алюминия и карбоната калия. Учитывая особенности гидролиза данных солей, подробно опишите происходящие при этом процессы.
Задача 11 – 3 (10 баллов). Решение. AlCl3 – соль, образованная сильной кислотой НCl и слабым основанием Al(ОН)3 (1 балл). . В водном растворе AlCl3 подвергается гидролизу. Первая ступень: Al+3 + НОН ⇄ Al(ОН)2+ + Н+ (1 балл).
Вторая ступень: Al(ОН)2+ + НОН ⇄ Al(ОН) 2+ + Н+ (1 балл).
Третья ступень: гидролиз не идет из-за накопления в растворе ионов водорода (1 балл).
Карбонат калия К2СО3 – соль, образованная слабой нестойкой кислотой Н2СО3 и сильным основанием КОН (1 балл), в водном растворе подвергается гидролизу:
Первая ступень: СО32- + НОН ⇄ НСО3 – + ОН– (1 балл).
Вторая ступень: гидролиз не идет из-за накопления в растворе гидроксид-ионов (1 балл).
При сливании растворов AlCl3 и К2СО3 ионы водорода первого раствора связываются гидроксид-ионами второго: Н+ + ОН– = Н2О. В соответствии с принципом Ле Шаталье равновесие смещается вправо и гидролиз двух солей идет до конца.
2AlCl3 + 3К2СО3 + 3Н2О = 2 Al(ОН)3 + 3СО2 + 6КСl (3 балла)
Задача 11 – 4. (9 баллов). Определите массовые доли (в %) сульфата железа(II) и сульфида алюминия в смеси, если при обработке 25 г этой смеси водой выделился газ, который
полностью прореагировал с 960 г 5%-ного раствора сульфата меди.
Задача 11 – 4 (9 баллов). Решение. 1) Составлены уравнения реакций: Al2S3 + 6H2O = 2Al(OH)3 + 3H2S; CuSO4 + H2S = CuS +H2SO4 (2 балла). 2) Рассчитано количество вещества сероводорода: n (CuSO4) = 960 ∙ 0,05 / 160 = 0,3 моль; n(H2S) = n(CuSO4) = 0,3 моль (2 балла). 3) Рассчитаны количество вещества и массы сульфида алюминия и сульфата железа(II): n (Al2 S 3) =  n (H 2S) = 0,1моль; m(Al2 S 3) = 0,1∙150 =15 г; m(FeSO4) = 25 -15 = 10 г (3 балла). 4) Определены массовые доли сульфата железа(II) и сульфида
n (H 2S) = 0,1моль; m(Al2 S 3) = 0,1∙150 =15 г; m(FeSO4) = 25 -15 = 10 г (3 балла). 4) Определены массовые доли сульфата железа(II) и сульфида
алюминия в исходной смеси: ω(FeSO4) = 10 / 25 = 0,4, или 40%; ω (Al2S3) =15 / 25 = 0,6, или 60% (2 балла).
Задача 11 - 5. (12 баллов). Химические свойства хлора и йода отличаются во многих деталях. Приведите примеры, в которых хлор и йод реагируют по-разному.
Задача 11 - 5. (12 баллов).Решение. 1. С металлической медью или железом при нагревании: 2Сu + I2 =2CuI; Cu + Cl2 = CuCl2; Fe + I2 → Fe I2; 2Fe + 3Cl2 → 2FeCl 3 (4 балла)..
2. Со фтором: I2 + 5F2 → 2IF5; Cl2 + 3F2 → 2ClF3 (2 балла).
3. С раствором щелочи на холоде: 2NaOH + Cl2 → NaCl + NaOCl + H2O; 6NaOH + 3I2 → 5NaI + NaIO3 + 3H2O (2 балла).
4. С раствором тиосульфата натрия: Na2S2O3 + 4Cl2 + 5H2O → Na2SO4 + H2SO4 + 8HCl; Na2S2O3 + I2 → Na2S4O6 +2NaI (2 балла).
Задача 11- 6. (20 баллов). Нарушается ли принцип Ле Шателье? Аммиак – самый многотоннажный продукт химической промышленности, ежегодно его получают более 100 млн. тонн. Реакция синтеза обратима: N2 + 3H2 ⇄ 2NH3. При 200 °C и давлении 1 атм константа равновесия, выраженная через мольные доли, Kx = 1, а при 400 °C и том же давлении Kx = 0,01.
1. Напишите выражение для константы равновесия Kx.
2. С выделением или поглощением теплоты происходит реакция синтеза аммиака? Объясните.
3. Сколько молей аммиака может образоваться при 200 °C из 1 моль N2 и 3 моль H2?
4. В равновесной смеси при некоторых условиях находится 0,65 моль N2, 0,25 моль H2 и 0,1 моль NH3. В какую сторону сместится равновесие при добавлении к этой смеси 0,25 моль азота? Объясните ваш ответ.
Задача 11-6 (автор – Ерёмин В. В.) (20 баллов).Решение 1. 
2. При нагревании константа равновесия уменьшается, то есть равновесие смещается в сторону реагентов. Согласно принципу Ле Шателье это означает, что реакция идёт с выделением теплоты.
3. Пусть в реакцию вступило a моль N2, тогда прореагировало 3 a моль H2 и образовалось 2 a моль NH3. Общее количество вещества после реакции: n(N2) + n(H2) + n(NH3) = (1– a) + (3–3 a) + 2 a = 4 – 2 a.
 .
.
 .
.
 .
.
a = 0,34.
n(NH3) = 2 × 0,34 = 0,68 моль.
4. Рассчитаем мольные доли веществ после добавления азота и составим из них величину Q, по форме аналогичную константе равновесия:
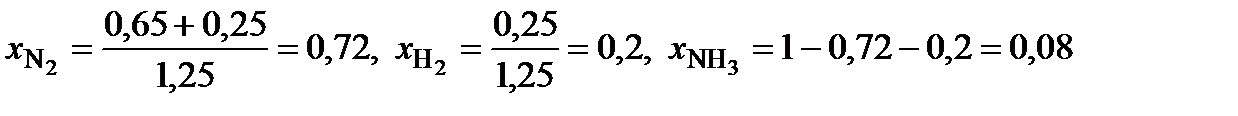 .
.
 .
.
Это значение превышает значение константы равновесия:
 .
.
Это означает, что продукта реакции больше, чем необходимо в равновесной смеси, следовательно, для достижения равновесия должна пойти обратная реакция. Таким образом, в данном случае добавление реагента приводит к смещению равновесия влево.
Комментарий: Это противоречит традиционной формулировке принципа Ле Шателье (но не самому принципу!). Кажущееся противоречие объясняется тем, что количество азота в исходной смеси сильно превышает стехиометрическое, поэтому дальнейшее добавление азота термодинамически невыгодно.
Система оценивания
1. За правильное выражение для константы равновесия 2 балла
2. 2 балла за правильный ответ (выделение теплоты), 2 балла за объяснение 4 балла
3. За правильный расчёт числа молей 6 баллов
4. 2 балла за правильный ответ (равновесие сместится влево),
6 баллов за объяснение с расчётом (4 балла за объяснение без расчёта) 8 баллов
ИТОГО20 баллов
Список литературы и интернет-ресурсов
1. Артемов А.В. Школьные олимпиады. Химия 8 – 11 классы. – М.: Айрис-пресс, 2007. – 240 с.
2. Всероссийская химическая олимпиада школьников: Кн. Для учителя/ П.А.Оржековский, Ю.Н.Медведев, А.В.Чураков, С.С.чуранов; Под редакцией Г.В.Лисичкина. – М.: Просвещение, учебная литература, 1996. – 192 с.
3. Габриелян О.С. Химия. 8 – 11 классы. Региональные олимпиады. 2000/2002/авт. Сост. О.С.Габриелян, А.Н.Прошлецов. – М.:Дрофа, 2005. – 287 с.
4. Габриелян О.С. Химия, 8 класс: учебник для общеобразовательных учреждений – 13 – изд., испр. – М.: Дрофа, 2008. – 270 с.
5. Хомченко И.Г. Решение задач по химии. – М.: РИА «Новая волна»: Издатель Умеренков, 2010 – 256 с.
6. Портал Всероссийской олимпиады школьников. Химия – http://chem.rosolymp.ru/
7.
 2017-12-14
2017-12-14 1119
1119







