Пример. Сколько водорода можно получить из 49 г серной кислоты при её взаимодействии с необходимым количеством цинка, если выход водорода равен 94% от теоретически возможного?
Решение:
1) Сколько Н2 выделяется при взаимодействии 59 г H2SO4 c необходимым количеством Zn?
49 г Х г
H2SO4 + Zn = ZnSO3 + Н2
98 2
98 - 2 98: 49 = 2: Х
49 - Х Х =  = 1.
= 1.
Х = 1 (г).
2) Сколько водорода образуется при 94% - ном выходе от теоретически возможного?
1 г - 100% 1: Х = 100: 94 Х =  = 0,94
= 0,94
Х г - 94%
Х = 0,94 (г).
Ответ: 0,94 (г).
Справочный материал:
Массовая доля выхода продукта реакции (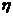 )- это отношение массы продукта реакции, полученного практически, к массе продукта, рассчитанного теоретически:
)- это отношение массы продукта реакции, полученного практически, к массе продукта, рассчитанного теоретически: 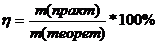
Задания:
1)Сколько требуется водорода и хлора для получения 100 кг 28%-ной соляной кислоты, если водород берется с избытком в количестве 3% от теоретически необходимого? (Ответ: 0,79 кг Н2, 27,23 кг Cl2.)
2)Сколько пирита, содержащего 90% сульфида железа FeS2, дает в результате обжига 2 кг оксида серы(IY) газа при 92%-ном выходе? (Ответ: 2 кг 264 г)
3)На производстве 2 т железного купороса, содержащего 52,5% FeSO4 израсходовано 0,5 т железного лома. Какой процент от теоретически возможного составляет выход FeSO4? (Ответ: 77.3%)
 2018-01-08
2018-01-08 387
387








