3.1. Цель работы
Получить понятие об идеальных и реальных газах, какими термодинамическими параметрами описывают их состояние, и какие законы при этом используют.
3.2. Задачи работы
Провести эксперимент, и с помощью математической обработки опытных данных проверить закон Клапейрона.
3.3. Теоретические положения
Рабочим телом называют вспомогательное вещество, используемое для работы той или иной тепловой машины (теплового двигателя, холодильной установки, теплового насоса). В подавляющем большинстве случаев рабочее тело является газообразным веществом.
Рабочие газообразные тела обычно делят на идеальные и реальные газы. Под идеальным газом понимают воображаемый газ, в котором отсутствуют силы межмолекулярного взаимодействия, а сами молекулы имеют пренебрежимо малый объем. Реальный газ состоит из молекул, объемом которых пренебречь нельзя и между молекулами существуют силы взаимодействия. Одно и то же рабочее тело относят к идеальному газу или реальному в зависимости от термодинамического состояния, в котором оно находится.
|
|
|
Термодинамическое состояние газообразного вещества характеризуется тремя основными параметрами: абсолютное давление, удельный объем и температура.
Для измерения давления используют барометры, манометры и вакуумметры различных типов. С помощью барометров измеряют атмосферное давление. Манометры используют для измерения разности давлений в резервуаре (установке) и атмосферным в том случае, если это давление больше атмосферного. В противном случае используются вакуумметры.
Абсолютное давление подсчитывают по формулам:
РАБС = РМАН + РБАР (3.1)
РАБС = РБАР – РВАК - (3.2)
где РАБС, РМАН, РБАР, РВАК – соответственно, абсолютное, манометрическое, барометрическое давление и давление вакуумметра.
Для измерения давления пользуются различными единицами измерения. Соотношения между этими единицами следующие:
1 Па = 1 Н/м2
1 атм. = 105 Па = 760 мм рт. ст.,
1 мм рт. ст. = 13,5951 мм вод. ст.
Удельный объем вещества представляет собой объем, занимаемый единицей массы этого вещества:
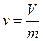 (3.3)
(3.3)
где V – действительный объем тела, м3;
m – масса тела, кг.
При измерении температуры пользуются термометрами различных типов и двумя основными температурными шкалами: шкалой Цельсия и абсолютной (шкалой Кельвина).
Связь между абсолютной температурой и температурой по шкале Цельсия выражается формулой:
Т = t + 273 (3.4)
где Т – абсолютная температура, К;
t – температура по шкале Цельсия, ºС.
Для сравнения различных газов между собой по объему их приводят к гак называемым нормальным физическим условиям (НФУ), характеризующимся давлением РН = 760 мм рт. ст. (0,1013 МПа) и температурой tН = 0 ºС (273 К).
|
|
|
Основные параметры газа связаны между собой функциональной зависимостью, называемой уравнением состояния:
f (р, v, Т) = 0 (3.5)
Наиболее простым уравнением состояния является уравнение Клапейрона-Менделеева для идеального газа:
p∙V = m∙ RГ ∙T (3.6)
где р – абсолютное давление газа, Па;
V – действительный объем газа, м3;
m – масса газа, кг;
RГ – индивидуальная газовая постоянная, Дж/(кг∙К) (см. приложение 2);
Т – абсолютная температура, К.
Для 1 кг газа уравнение (3.6) имеет вид:
р∙v = RГ ∙T (3.7)
где v – удельный объем, м3/кг.
Газовая постоянная RГ представляет собой физическую постоянную, которая для каждого газа принимает вполне определенное значение, зависящее от природы газа и не зависящее от его состояния.
Уравнение (3.7) можно записать для 1 кмоль газа, умножая обе части уравнения на молекулярную массу μ:
p∙v∙μ = μГ ∙RГ∙T или p∙Vμ = μ∙RГ∙T (3.8)
где μГ – молекулярная масса газа, кг/кмоль (см. приложение 2);
Vμ – объем одного кмоль вещества, м3/кмоль;
μ∙RГ = Rμ – универсальная газовая постоянная, Дж/(кмоль∙К).
Универсальная газовая постоянная Rμ не зависит от состояния газа и одинакова для всех идеальных газов. Значение Rμ можно определить из уравнения (1.8), записывая его для НФУ, при которых Vμ любого идеального газа равен 22,4 м3/кмоль (следствие из закона Авогадро):
Rμ = 8314 Дж/(кмоль∙К).
Зная универсальную газовую постоянную Rμ, можно подсчитать индивидуальную газовую постоянную RГ, которую иногда, в отличие от универсальной, называют характеристической:
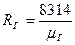 , Дж/(кг∙К) (3.9)
, Дж/(кг∙К) (3.9)
 2017-10-25
2017-10-25 954
954








