Эквивалентная молярная масса вещества
Молярная масса эквивалентов обычно обозначается как 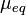 или
или 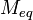 . Отношение эквивалентной молярной массы вещества к его собственно молярной массе называется фактором эквивалентности (обозначается обычно как
. Отношение эквивалентной молярной массы вещества к его собственно молярной массе называется фактором эквивалентности (обозначается обычно как 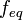 ).
).
Молярная масса эквивалентов вещества — масса одного моля эквивалентов, равная произведению фактора эквивалентности на молярную массу этого вещества.
Mэкв = fэкв×M
Молярная масса
В химических процессах участвуют мельчайшие частицы – молекулы, атомы, ионы, электроны. Число таких частиц даже в малой порции вещества очень велико. Поэтому, чтобы избежать математических операций с большими числами, для характеристики количества вещества, участвующего в химической реакции, используется специальная единица – моль.
Моль это такое количество вещества, в котором содержится определенное число частиц (молекул, атомов, ионов), равное постоянной Авогадро
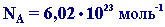
Молярная масса вещества (M) – масса, которую имеет 1 моль данного вещества.
Эта величина, равная отношению массы m вещества к количеству вещества ν, имеет размерность кг/моль или г/моль. Молярная масса, выраженная в г/моль, численно равна относительной относительной молекулярной массе Mr (для веществ атомного строения – относительной атомной массе Ar).
Например, молярная масса метана CH4 определяется следующим образом:
3. В равных объемах газов (V) при одинаковых условиях (температуре Т и давлении Р) содержится одинаковое число молекул.
Первое следствие из закона Авогадро: один моль любого газа при одинаковых условиях занимает одинаковый объём.
Второе следствие из закона Авогадро: молярная масса первого газа равна произведению молярной массы второго газа на относительную плотность первого газа по второму.
Моль - это такое количество вещества, в котором содержится определенное число частиц (молекул, атомов, ионов), равное постоянной Авогадро(N=6,022*10^23)
Закон Дюлонга-Пти (Закон постоянства теплоёмкости) — эмпирический закон, согласно которому молярная теплоёмкость твёрдых тел при комнатной температуре близка к 3R:
где R — универсальная газовая постоянная.
Газовые законы:
1.Закон Авагадро
2. Массы равных объемов двух газов должны относится друг к другу как их молярные массы m1/m2=M1/M2
3. Молярная масса газа равна его плотности по отношению к другому газу умноженной на молярную массу второго газа:M1=D*M2
4. Сте́пень окисле́ния (окислительное число, формальный заряд) — вспомогательная условная величина для записи процессов окисления, восстановления и окислительно-восстановительных реакций, численная величина электрического заряда, приписываемого атому в молекуле в предположении, что электронные пары, осуществляющие связь, полностью смещены в сторону более электроотрицательных атомов.
Степень окисления соответствует заряду иона или формальному заряду атома в молекуле или в химической формальной единице, например:
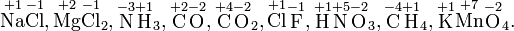
Степень окисления указывается сверху над символом элемента. В отличие от указания заряда иона, при указании степени окисления первым ставится знак, а потом численное значение, а не наоборот:
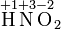 --- степень окисления,
--- степень окисления,
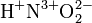 ------ заряды. (НЕ ПЕРЕПУТАЙТЕ)
------ заряды. (НЕ ПЕРЕПУТАЙТЕ)
Степень окисления атома в простом веществе равна нулю, например:
Алгебраическая сумма степеней окисления атомов в молекуле всегда равна нулю:
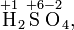
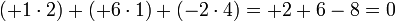
Окисление – процесс повышения степени окисления
Восстановление – процесс понижения степени окисления
Атом, находящийся в высшей степени окисления, может быть только окислителем, в низшей только восстановителем, если он обладает промежуточной степенью окисления, то может быть и окислителем, и восстановителем.
Пример: S
Восстановитель: 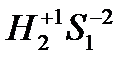 (+1*2+(-2*1))=0
(+1*2+(-2*1))=0
Окислитель: 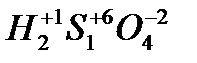
Окислит/Восстановит: 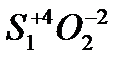
Различают 4 типа О.В.Р
1. Межмолекулярное окисление-восстановление (Окислит. и восстановит. разные вещ-ва)
2. Внутримолек-е О.В.Р при которых степень окисления изменяют атомы разных электронов одного и того же вещества 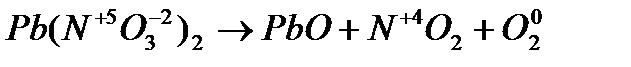
изменяет степень окисления азот 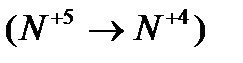 и атом кислорода
и атом кислорода 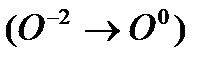 , находящийся внутри молекулы
, находящийся внутри молекулы 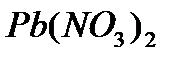
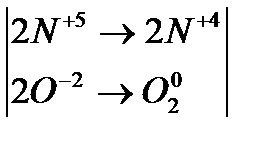
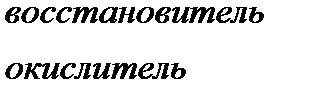
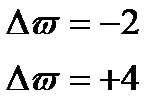
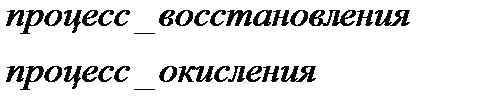
Составляем уравнение реакции 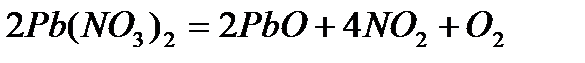
3. Реакция самоокисления-самовосстановления. В этом случае степень окисления одного и того же элемента и повышается и понижается
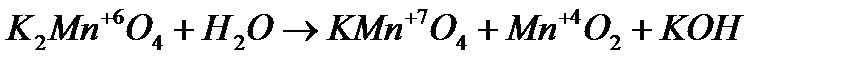 Определим степени до и после реакции
Определим степени до и после реакции
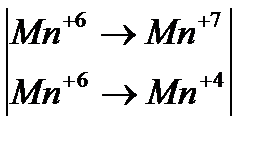
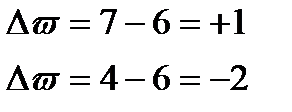
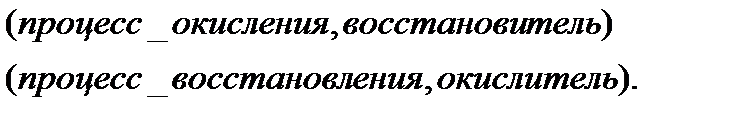
Поскольку в данной реакции окислителем и восстановителем выступает одно и то же вещество 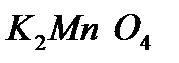 , коэффициенты перед ним суммируются. Записываем уравнение
, коэффициенты перед ним суммируются. Записываем уравнение 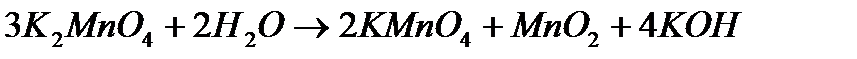
4. Внутримолекулярные реакции окисления-восстановления, в которых происходит выравнивание степеней окисления атомов одного и того же элемента, являются процессами контрдиспропорционирования 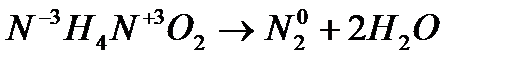

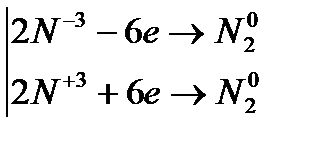
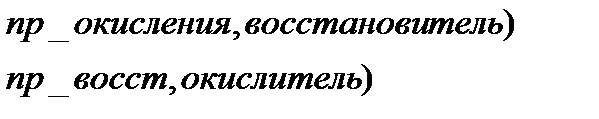
Эквивалентная молярная масса окислителя и восстановителя определяется делением молярной массы на изменение степени окисления(на 1 моль вещества)
Квантовые числа
Четыре квантовых числа описывают состояние электрона в атоме и характеризуют энергию электрона, его спин, форму электронного облака и его ориентацию в пространстве.
При переходе атома из одного состояния в другое происходит перестройка электронного облака, т.е. изменяются значения квантовых чисел, что сопровождается поглощением или испусканием атомом квантов энергии
 2018-01-21
2018-01-21 449
449







