(нафта, супутний нафтовий газ, природний газ вугілля, гарючі сланці)
Нафта – суміш насичених та ненасичених вуглеводів. Представляє собою темну оліїсту рідину із специфічним запахом. Легша за воду і нерозчинна в ній. Не має певної температури кипіння густина = 0.82 – 095 г/мл
Переробка нафти – первинна та вторинна
Первинна (перегонка) – нафту можно розділити на окремі суміші із близькими температурами кипіння – фракції.
Вторинна (крекінг та риформінг)
Крекінг – один із найважливіших нафтопереробних процесів. Полягає в нагріванні високотемпературних фракцій при якому вуглеводні розкладаються з розривом і перебудовою карбонових ланцюгів у молекулах. Існує термічний і каталітичний крекінг.
Термічний крекінг – процес, під час якого молекули вищих алканів розщеплюються на молекули алканів та алкенів з меншою довжиною карбонових ланцюгів.
С16Н34 t,p C8H18 + C8H16
Каталітичний крекінг – поряд з розкладом молекул вуглеводнів відбувається ізомеризація продуктів реакцій. У результаті утворюються переважно вуглеводні розгалуженої будови, а також циклічні і ароматичні.
|
|
|
С8Н18 t,p C6H14 + C2H4
Риформінг – процес, який здійснюють у широкому інтервалі температур і тисків за участю каталізатора, під час якого відбувається різноманітні перетворення вуглеводнів: ізомеризація, алкілування, циклізація, ароматизація.
CH3
CH3-CH2-CH2-CH2-CH3 t, AlCl3 CH3-CH2-CH3
CH3
Супутний нафтовий газ – суміш газуватих вуглеводнів, які містяться у нафтових родовищах. За якісним складом нагадує природний, але метану в ньому менше. Добувають: метан, етан, пропан, бутан, газовий бензин.
Природний газ – складається в основному з метану, містить такі домішкі, як етан, азот, вуглекислий газ, сірководень. Не має запаху, горючий, а його суміш з повітрям вибухонебезпечна.
Вугілля – тверда горюча копалина, яка утворилася багато мільйонів років тому в надрах планети, в результаті тривалого розкладу величезних рослинних мас. Це суміш багатьох органічних речовин з високим вмістом карбону і деяких неорганічних сполук. Існує 3 види вугілля: антрацит, кам’яне, буре. Існує 3 способи хімічної переробки вігулля: коксування, газифікація та гідрування.
Коксування – розклад вугілля при високій температурі за відсутності повітря. Під час усього процесу утворюється кокс, коксовий газ, кам’яновугільна смола, надсмольна вода.
Кокс – пориста речовина темносірого кольору, шо містить 96-98% карбону, а також О і Н.
Коксовий газ – водень, метан, чадний газ, азот, аміак, пари бензину. Пропускаючи коксовий газ крізь розчин сульфатної кислоти із нього вилучають аміак, який взаємодіє з кислотою з утворення амоній сульфату (NH4)2SO4
|
|
|
4NH3 + 5O2 Pt 4NO + 6H2O
2NO + 2O2 2NO2 добування HNO3 з аміаку
4NO2 + O2 +2H2O 4HNO3
NH3 + HNO3 (NH4)NO3 аміачна сілітра
HNO3 + KOH KNO3 + H2O
Надсмольна вода містить розчинені гази – вуглекислий газ, сірководень, хлороводень, ціановодень, солі амонію, аміак.
Камяновугільна смола – густа чорна рідина із специфічним запахом.
Газифікація - перетворення вугілля на горючі гази.
2С + O2 2CO; C + H2O CO + H2; C + 2H2 CH4
C + O2 CO2; CO + H2O CO2 + H2; CO + 3H2 CH4 + H2O
C + CO2 2CO
nCO + (2n+1)H2 t, p, k CuH2n+2 + nH2O
Гідрування – перетворення вугілля на рідки та газуваті вуглеводні під дією водню.
Тема 4. Спирти і феноли
Спирти
Спирти – це органічні сполуки, до складу яких входить одна або кілька гідроксильних груп –ОН, сполучених з вуглеводневим радикалом.
Лекція 1.
Насичені одноатомні
Загальна формула:
СnH2n+1OH
Гомологічний ряд:

Ізомерія:
1) За радикалом
2) За гідроксогрупою
Розрізняють первинні, вторинні та третинні спирти.
 Будова:
Будова:
Sp3-гібридизація
α у Карбону = 109о28/
α у Оксигену = 104о5/
Оскільки атом оксисену гідроксильної групи більш електронегативний, ніж атоми Карбону і Гідрогену, то в зв’язках С-О, О-Н електронна густина від атомів Гідрогену і Карбону змішується до атома Оксигену. Внаслідок цього на атомі Оксигену виникає частковий негативний заряд δ-. А на атомах Гідрогену і Карбону – δ+.
Н3Сδ+ -> Оδ- <- Нδ+
Отже зв’язки С-О і О-Н у молекулах спиртів є полярними.
Фізичні властивості:
Одноатомні спирти – безбарвні рідини з характерним запахом. Вищі спирти – тверді речовини без запаху. Температури кипіння значно вищі ніж у відповідних алканів. Це пояснюється наявністю у спиртах сильно полімерних зв’язків Оδ- <- Нδ+
Водневий зв’язок – зв’язок, що утворюється між атомами Гідрогену, сполученим з електронегативним елементом однієї молекули речовини, і атомом електронегативного елемента іншої молекули речовини.
Хімічні властивості
1. Кислотні властивості спиртів
Спирти проявляють дуже слабкі кислотні властивості - реагують з лужними або лужноземельними металами з утворенням алкоголятів
2СH3CH2OH + 2Na → 2СH3CH2ONa + H2
алкоголяти легко гідролізуються
СH3CH2ONa + H2O → СH3CH2OH + NaOH
2. Реакції з галогеноводнями (HCl, HBr)
R–OH + HCl R–Cl + H2O
3. Реакції дегідратації
• внутрішньомолекулярна дегідратація (t>140oC, H2SO4(k))
CH3-CH2-OH → CH2=CH2 + H2O
• міжмолекулярна дегідратація (t<140oC, H2SO4(k))
2CH3-CH2-OH → CH3-CH2-О-CH2-CH3
4. Реакції окислення
| CuO, t |
| Ag2O/NH2 |

*ці окисники можна замінити на K2Cr2O7, H+
• вторинні спирти окислюються до кетонів
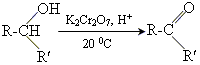
• третинні спирти стійкі до дії звичайних окислювачів
5. Реакція горіння спиртів
С2H5ОH + 7/2O2 → 2СO2 + 3H2O
6. Реакція етерифікації, у присутності каталізатора - сульфатної кислоти:
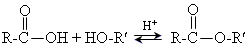
Добування:
1) Приєднання води до алкенів (гідратація):

або 
2) Із галогенопохідних:

або

3) Каталітичний синтез метанолу з карбон(ІІ) оксиду і Гідрогену за температури близько  , тиску 7 МПа, каталізатор — суміш цинк оксиду і купрум(II) оксиду:
, тиску 7 МПа, каталізатор — суміш цинк оксиду і купрум(II) оксиду:

4) Етанол утворюється в результаті бродіння глюкози:

Застосування:
Етанол застосовують для добування синтетичного каучуку, пластмас, різних органічних речовин: діетилового естеру, барвників, оцтової кислоти. Його використовують як розчинник для виготовлення парфумів, одеколонів, ліків, лаків і т. д. Етанол у суміші з бензином можна використовувати як пальне для двигунів внутрішнього згоряння.
Метанол застосовують як розчинник або сировину для одержання формальдегіду, деяких барвників, фотореактивів, фармацевтичних препаратів.
Фізіологічна дія на організм людини:
Метиловий спирт дуже отруйна речовина, діюча на нервову і судинну системи людини. При попаданні в організм людини 10 мл метанолу може призвести до важкого отруєння, до сліпоти. А попадання 25-30 мл метанолу призводить до смертельного випадку.
|
|
|
При вживанні в середину спирт етиловий швидко всмоктується в основному у тонкому кишечнику - 80%, і 20% у шлунку. Найшвидше всмоктування в ШКТ відбувається натще, сповільнюється при наявності жирів та вуглеводів,які гальмують цей процес.
Стадія збудження являється результатом пригнічення гальмівних механізмів мозку - вона виражена і продовжена в порівнянні з засобами для наркозу
Лекція 2.
Багатоатомні спирти
Найпростішим двохатомним спиртом є етиленгліколь НО-СН2-СН2-ОН, трьохатомним – гліцерин НО-СН2-СНОН-СН2-ОН.
Етиленгліколь:
Фізичні властивості
Безбарвна в’язка рідина без запаху, солодка на смак, важча за воду, добре в ній розчинна. Є токсичною речовиною, температура кипіння 198ОС.
Хімічні властивості
Етиленгліколь вступає у всі реакції, що є характерними для одноатомних спиртів, але є і особливості пов'язані з наявністю двох гідроксогруп.
1. реакція з лужними металами дає два ряди гліколятів
OH-CH2-CH2-OH + Na → OH-CH2-CH2-ONa + 1/2H2;
OH-CH2-CH2-OH + 2Na → Na-CH2-CH2-ONa + H2
2. при взаємодії з галогеноводневими кислотами (HCl або HBr) легко заміщується лише одна гідроксогрупа
OH-CH2-CH2-OH + HCl → Cl-CH2-CH2-OH + H2O
3. на відміну від одноатомних спиртів, характерною особливістю етиленгліколю є реакція взаємодії з гідроксидом Купруму, в результаті якої утворюється розчинний комплекс яскраво-синього забарвлення

Добування
• отримання з етилену
CH2=CH2 + Cl2 → Cl-CH2-CH2-Cl
Cl-CH2-CH2-Cl + H2O → OH-CH2-CH2-OH
• отримання за реакцією Вагнера

Застосування:
Завдяки своїй дешевизні етиленгліколь знайшов широке застосування в техніці.
§ Як компонент автомобільних антифризів і гальмівних рідин, що становить 60% його споживання. Суміш 60% етиленгліколю і 40% води замерзає при −45 ° С. Корозійно активний, тому застосовується з інгібіторами корозії;
§ Як теплоносій у вигляді розчину в автомобілях, в системах рідинного охолодження комп'ютерів;
§ У виробництві целофану, поліуретанів і ряду інших полімерів. Це друге основне застосування;
|
|
|
§ Як розчинник фарбувальних речовин;
§ У органічному синтезі
Гліцерін
Фізичні властивості:
Безбарвна рідина без запаху з солодким смаком. Неотруйний. Температура кипіння 290оС.
Хімічні властивості:
Гліцерин за своїми властивостями більш подібний до етиленгліколю, ніж до одноатомних спиртів. Так, гліцерин дає три ряди гліцератів і три ряди похідних при взаємодії з галогеноводнями. Як і етиленгліколь, гліцерин при взаємодії з гідроксидом Купруму утворює з комплекс яскраво-синього забарвлення.
1. реакція гліцерину з гідроксидом Купруму(ІІ) (якісна реакція)

2.  .
.
Добування
1. З пропілену через наступні стадії:
CH3-CH=CH2 + Cl2 hV CH2Cl-CH=CH2;
CH2Cl-CH=CH2 + Cl2 → CH2Cl-CHCl-CH2Cl;
CH2Cl-CHCl-CH2Cl + 3NaOH→ CH2OH-CHOH-CH2OH + 3NaCl.
(водний розчин)
2. Гідроліз жирів

Застосування:
Гліцерин використовується в парфумерії та фармації як зм'якшувальний засіб або основа мазей, добавка до масла, у харчовій промисловості — як добавка до напоїв. У шкіряному виробництві та текстильній промисловості — для обробки пряжі і шкіри з метою їх пом'якшення та надання еластичності. З гліцерину добувають вибухову речовину тринітрогліцерин, що використовується для виготовлення динаміту. Спиртовий розчин тринітрогліцерину має судинорозширювальну дію й у вигляді ліків використовується при серцевих захворюваннях.
Лекція 3.
Феноли
Визначення:
Феноли — органічні речовини, до складу яких входить одна або декілька гідроксогруп, що зв'язані з ароматичним ядром.
Будова:
Взаємний вплив атомів у молекулі має електронну природу. У наслідок спряження неподілених електронів атома Оксигену з електронною системою бензенового ядра зв'язок О—Н послаблюється, атом Гідрогену набуває більшої рухливості, ніж у спиртах. У свою чергу, підвищується електронна густина в орто- і пара-положеннях бензенового ядра:

Фізичні властивості:
Фенол – тверда кристалічна безбарвна речовина із специфічним запахом. Помірно розчиняється у холодній воді, а з гарячою змішується, утворюючи розчин. Отруйна речовина. tплавління=41оС, tкип=182оС.
Хімічні властивості:
У зв'язку з наявністю в молекулі функціональної гідроксильної групи та бензенового ядра фенол виявляє властивості, подібні до бензену та спиртів.
1. Кислотні властивості фенолів

2. Реакції заміщення
Реакції заміщення протікають значно легше, ніж у випадку бензену, оскільки гідроксогрупа суттєво активує бензольне ядро.
• реакція нітрування

• реакції галогенування (-Cl, -Br)
*Якісна реакція: білий осад

• реакція сульфування

| Н NaOH |

4. Утворення складних ефірів
| NaOH |

5. Заміщення гідроксогрупи на галоген (протікає значно гірше, ніж у випадку спиртів)
| -РОCl3 |

6. Відщеплення гідроксогрупи
| -ZnO |

7. Реакція поліконденсації з формальдегідом (отримання фенолформальдегідних смол)

8. Горіння
Фенол повністю окиснюється до вуглекислого газу і води.
C6H5OH + 4O2 = 3CO2 + 3H2O;
9. Якісна реакція на фенол
Взаємодія з розчином FeCl3 з утворенням сполуки фіолетового кольору:
3С6H5OH+FeCl3→(C6H5O)3Fe+3HCl;
Добування
1. З кам'яновугільної смоли
2. Отримання з бензену і пропену (купольний спосіб)

3. Переробка бензену за такою схемою:

+Сl2/Al H2O
HClp=200 атм.
Застосування:
Виробництво бісфенолу А, який, в свою чергу, використовується для виробництва полікарбона і епоксидних смол; виробництво фенолформальдегідних смол; гідруванням перетворюється на циклогексанол, використовуваний для отримання штучних волокон - нейлону і капрону;
виробництво антиоксидантів (ионол) неіоногенних ПАР поліоксіетильовану алкилфенолов інших фенолів (крезолів) лікарських препаратів (аспірин), антисептиків (ксероформу) і пестицидів. Розчин 1,4% фенолу застосовується в медицині (Орасепт) як знеболюючий і антисептичний засіб.
Фенол і його похідні обумовлюють консервуючі властивості коптильного диму. Також фенол використовують як консервант у вакцинах. Приклад використання, як антисептик - препарат "Орасепт".
Лекція 4.
Бензиловий спирт
Фізичні властивості:
Безбарвна рідина зі слабким приємним запахом; tкип 205,8 ° C; щільність 1045,5 кг / м ³ (1,0455 г / см ³) при 20 ° C. Бензиловий спирт добре розчинний в органічних розчинниках і рідких SO 2 і NH 3, в 100 г води розчиняється 4 г бензилового спирту.
Хімічні властивості:
1. Взаємодія з лужними і лужноземельними металами:
2C6H5CH2OH + 2Na → 2C6H5CH2ONa + H2↑ утворюється бензалат натрію
2. Взаємодія з треххлорістий фосфором:
3C 6H5CH2OH + PCl3 → 3C6H5CH2Сl + H3PO 3 утворюється бензил хлорид
3. Взаємодія з оцтовим ангідридом:
2C6H5CH2OH + H3CC (O)-O-(O) C-CH3 → 2C6H5CH2O-(O)C-CH3 + H2O
утворюється бензиловий ефір оцтової кислоти (бензілацетат)
Добування:
1. Омилення бензілхлоріда в основному в присутності лугу:
C6H5CH2Cl + H2O → C6H5CH2OH + HCl
2. Дією лугу на суміш бензойного альдегіду і формальдегіду:
C6H5CHO + HCHO → C6H5CH2OH + HCOOH
Застосування:
Бензиловий спирт застосовують у парфумерії, а також як розчинник лаків. Також застосовується для знезараження масляних розчинів препаратів длявнутрішньом'язового введення в фармакології.
Зареєстровано в якості харчової добавки E1519.
 2018-01-21
2018-01-21 895
895








