Изобретение относится к области нефтехимического синтеза, точнее к производству бензола, толуола, о- и п-ксилолов.
Основным способом промышленного получения указанных углеводородов в настоящее время является каталитический риформинг бензинов. Процесс проводят при температуре 480-520о С, давлении водорода 7-25 ат. В этом процессе м-, о- и п-ксилолы получаются в равновесном отношении. Для получения о- и п-ксилолов используется процесс изомеризации м-ксилольной фракции на платиноморденит содержащем катализаторе. Недостатками процесса являются дефицитность и высокая стоимость сырья, необходимость циркуляции больших объемов водорода, экстрактивные методы выделения ароматических углеводородов вследствие присутствия парафиновых углеводородов с близкими температурами кипения, использование разных катализаторов в процессах каталитического риформинга и изомеризации м-ксилольной фракции.
Альтернативным способом получения ароматических углеводородов может быть получение из газообразных углеводородов С3-С4,ресурсыкоторыхвелики и использование недостаточно квалифицированное.
|
|
|
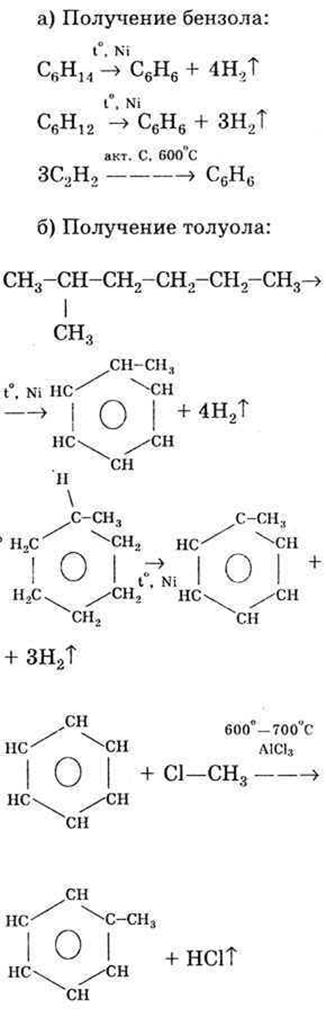
22.Реакции электрофильного замещения (SЕ) у аренов. Галогенирование, нитрование, сульфирование, алкилирование, ацилирование ароматических соединений (бензола, толуола, анилина, фенола, нитробензола). Правила ориентации в бензольном кольце.
Нитрирование - введение питрогруппы - NO2 в молекулы органических соединений. Может проходить по электрофильному, нуклеофильному и радикальному механизмам; активные частицы в этих реакциях - соответственно катион нитрония NO2, нитрит - ион NO2 и радикал NO2. нитрирование может осуществляться по атомам С, N, О замещением атома водорода (прямое нитрирование) или других функциональных групп (заместительное нитрирование) либо в результате присоединения группы NO2; по кратной связи.
Электрофильное нитрование.Среди электрофильных нитрующих агентов доминирующее положение занимает HNOз. Безводная и концентрированная HNO3, способны к самопротонированию: HNO3 + NO3(-) = NO2(+) + NO3(-) + H3O(+). Присутствие воды снижает концентрацию NO2 и в 93- 95%-ной HNO3 спектрофотометрически он уже не обнаруживается. Для увеличения нитрующей активности HNO3 используют ее смеси с H2SO4 или олеумом, которые генерируют NO2, связывая воду:
2HNO3 + H2SO4 = NO2(+) + HSO4(-) + H3O(+)
Галогенирование (замещение галогеном) - важнейшая реакция алканов. Замещение водородных атомов галогенами- одна их наиболее характерных реакций предельных углеводородов. В качестве галогенирующих агентов можно применять не только хлор, но и бром. Йод не способен к реакции прямого замещения водорода, фтор действует слишком энергично, если не принять особых мер со свободным фтором реакция идет со взрывом.
|
|
|
Скорость галогенирования резко снижается в ряду:F>Cl>Br>I. Хлор реагирует с предельными углеводородами только под влиянием света, нагревания (300 оС) или в присутствии катализаторов, причем последовательно замещаются хлором все атомы водорода:
При взаимодействии алканов с галогенами (хлором и бромом) образуется смесь продуктов от моно- до полигалогензамещенных алканов. При накоплении первого продукта замещения - метилхлорида CH3Cl -возникает возможность атаки его атомом хлора и образования свободного радикала
*CH2Cl, который при дальнейшей реакции с радикалом Cl*, дает двузамещенный продукт - дихлорметан CH2Cl2.
При избытке хлора произойдет и дальнейшее замещение с образование соединений CH3Cl и CCl4.
Реакция галогенирования имеет цепной свободно-радикальный характер. Реакция образования хлорметана протекает по цепному механизму, который характеризуется следующими стадиями:
а) инициирование цепи:
б) Рост цепи. Радикал хлора отнимает у молекулы алкана атом водорода:
Cl+ СН4>НСl + СН3
При этом образуется алкильный радикал, который отнимает атом хлора у молекулы хлора:
СН3+ Сl2>СН3Сl + Сl
Эти реакции повторяются до тех пор, пока не произойдет обрыв цепи по одной из реакций:
Cl + Cl > Сl2, СН3 + СН3 > С2Н6, СН3 + Cl > СН3Сl
Сульфирование
Арены взаимодействуют с концентрированной серной кислотой или олеумом (раствор SO3 в серной кислоте) с образованием аренсульфокислот:
ArH + H2SO4 = ArSO3H + H2O
Электрофильной частицей является SO3. Атаку ароматического субстрата осуществляет атом серы, поскольку он сильно положительно поляризован, то есть электронодефицитен:
Сульфирование является обратимым процессом. Сульфогруппа может удаляться из ароматического ядра, что широко используется в органическом синтезе.
Алкилирование по Фриделю-Крафтсу
Подобно галогенам, алкилгалогениды могут быть так сильно поляризованы кислотами Льюиса (хлоридами алюминия и цинка, трифторидом бора и др.), что они становятся способными к электрофильному замещению в ароматическом ядре:
Кроме алкилгалогенидов для алкилирования ароматических соединений могут использоваться алкены или спирты в присутствие катализатора - протонной кислоты:
Присутствие катализатора – протонной кислоты необходимо для генерирования электрофильной частицы – карбокатиона:
Алкилирование аренов алкенами происходит в соответствии с правилом Марковникова.
Продукты алкилирования легче вступают в реакции электрофильного ароматического замещения, чем исходное соединение (Alk - электронодонорная группа), поэтому дальше преимущественно алкилируется продукт и образуются продукты полиалкилирования. Если хотят получить продукты моноалкилирования, то необходимо брать большой избыток ароматического соединения.
 2018-01-21
2018-01-21 2637
2637








