 C2 H5Br + KCN C2H5CN + KBr
C2 H5Br + KCN C2H5CN + KBr
нитрил пропионовой кислоты
 C2H5C ≡ N + 2HOH C2H5COOH + NH3
C2H5C ≡ N + 2HOH C2H5COOH + NH3
пропионовая кислота

 O
O

 C2H5Br + CH3 – COOAg CH3 – C + AgBr
C2H5Br + CH3 – COOAg CH3 – C + AgBr
O – C2H5
ацетат серебра этилацетат
 C2H5Br + C3H7ONa C2H5 – O – C3H7 + NaBr
C2H5Br + C3H7ONa C2H5 – O – C3H7 + NaBr
пропилат натрия этилпропиловый эфир
 С2H5J + AgNO2 C2H5NO2 + AgJ
С2H5J + AgNO2 C2H5NO2 + AgJ
нитроэтан

 СH3COOC3H7 C6H14
СH3COOC3H7 C6H14
CH3COOAg 2Na


 C3H7Cl AgCl NaOH, спирт.р-р CH3 – CH = CH2
C3H7Cl AgCl NaOH, спирт.р-р CH3 – CH = CH2


 KCN C3H7J NaOH, водн. р-р
KCN C3H7J NaOH, водн. р-р
 C3H7CN C3H7ONa NH3 C3H7OH
C3H7CN C3H7ONa NH3 C3H7OH
C3H7OC3H7 C3H7NH2
Образование реактива Гриньяра:
эфир
 C2H5Br + Mg C2H5MgBr
C2H5Br + Mg C2H5MgBr
этилмагнийбромид
Галогеноалкилы применяются для получения тетраэтилсвинца (ТЭС): Pb(C2H5)4. ТЭС – светлая, ядовитая жидкость, применяется как эффективный антидетонатор. Его добавляют к моторному топливу для снижения детонации. Получают ТЭС из хлористого этила, сплава натрия и свинца:
 4 C2H5Cl + 4 NaPb Pb(C2H5)4 + 3 Pb + 4 NaCl
4 C2H5Cl + 4 NaPb Pb(C2H5)4 + 3 Pb + 4 NaCl
Реакция протекает в газообразном азоте. Образуются этильные радикалы, которые взаимодействуют со свинцом. Одновременно происходят побочные реакции, такие как диспропорционирование:
 2 С2H5 • C2H4 + C2H6,
2 С2H5 • C2H4 + C2H6,
а также рекомбинация:
 C2H5 • + C2H5 • C4H10
C2H5 • + C2H5 • C4H10
ТЭС называют этиловой жидкостью, которую добавляют к бензину от 0,20 до 0,75 мл на 1 л бензина. ТЭС очень ядовит, его пары проникают через кожу и поражают центральную нервную систему.
|
|
|
2. АЛИЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ
Органические соединения делятся на две большие группы – соединения с открытой цепью и циклические. Последние делятся на карбоциклические и гетероциклические.
Карбоциклические соединения построены только из атомов углерода, в то время как в циклах гетероциклических соединений имеются кроме атомов углерода другие атомы, называемые гетороатомами – это сера, азот, кислород, фосфор и другие.
Карбоциклические соединения делятся на алициклические и ароматические.
Простейшие алициклы называются циклопарафинами. Их называют еще полиметиленовыми углеводородами или нафтенами. Это название дано В.В. Марковниковым циклопарафинам с 5- и 6 – атомами углерода в цикле, обнаруженными в Кавказской нефти (80%). Углеводороды с шестичленными циклами называют гидроароматическими. В исследовании циклических углеводородов велика роль русских и советских ученых таких, как Марковников, Густавсон, Зелинский, Демьянов, Кижнер, Наметкин и другие. Большое значение имеют работы зарубежных ученых – Байера, Ружички, Неницеску и других.
Число атомов углерода в циклах колеблется от трех до нескольких десятков. Например, Ружичка получил кетон, содержащий 34 атома углерода в цикле.
Определение «алициклический» состоит из двух слов - «алифатический» и «циклический».
Известны предельные циклические углеводороды – циклоалканы с одним циклом и общей формулой CnH2n и непредельные циклические углеводороды – циклоалкены с общей формулой CnH2n – 2, циклоалкины, циклодиены с общей формулой CnH2n – 4. и другие.
|
|
|
Номенклатура
Правила в названии циклов сохраняется как и у ациклических соединений с добавлением слова «цикло». Например:







 СН2 – СН2 СН2 СН3 СН3 СН2-СН
СН2 – СН2 СН2 СН3 СН3 СН2-СН





 СН2 – СН2 СН2 СН2 1 СН 1 СН СН2-СН
СН2 – СН2 СН2 СН2 1 СН 1 СН СН2-СН






 циклобутан СН2 СН2 СН2 СН2 СН2 2 СН – С2Н5 циклобутен
циклобутан СН2 СН2 СН2 СН2 СН2 2 СН – С2Н5 циклобутен

 СН2 СН2 СН2 СН2– СН2
СН2 СН2 СН2 СН2– СН2
СН2
циклогексан метилциклогексан 1-метил-2-этилциклопентан
 1
1







 2 СН– 3 СН 1 CH = 2 CH 8 • • 2
2 СН– 3 СН 1 CH = 2 CH 8 • • 2
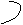





 1 СН 4 СН 8 CH 3 CH 7 • • 3
1 СН 4 СН 8 CH 3 CH 7 • • 3


 5 СН 7 CH 4 CH 6 4
5 СН 7 CH 4 CH 6 4
6 CH = 5 CH 5 •
циклопентадиен-1,3 циклооктатетраен-1,3,5,7 1,4,6-триметил- циклопропан
циклооктатриен-1,4,6
Циклические углеводороды обозначаются либо в виде формул с указанием атомов углерода, либо в виде правильной геометрической фигуры, а высшие циклические углеводороды могут обозначаться в виде окружности, где точками обозначаются атомы углерода, штрихами – метильные группы, а дугами – двойные связи.
Существует много алициклических соединений с конденсированными кольцами, то есть два цикла имеют одну общую сторону (или два общих углеродных атома). В названии учитывают все атомы углерода, входящие в циклы, и в скобках показывают число атомов углерода, находящихся между общими углеродными атомами. Нумерацию производят от разветвления по наиболее длинной цепи. Например:


 6 5 4 5 4 2
6 5 4 5 4 2




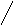






 СН2 – СН – СН2 СН3 – 3 1 8
СН2 – СН – СН2 СН3 – 3 1 8



 1 2 3 или 6 3 6 7
1 2 3 или 6 3 6 7
 СН – СН2 – СН2 1 2 4
СН – СН2 – СН2 1 2 4
5
бицикло[3.1.0]гексан 3-метилбицикло[4.2.0]-октен-2
Существуют бициклические соединения с числом общих углеродных атомов больше двух. Это мостиковые соединения:


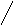







 7 7 СН2 9
7 7 СН2 9





 8 СН2 6 СН2 1 5
8 СН2 6 СН2 1 5



 1 6 9 СН2 или
1 6 9 СН2 или





 1 СН 5 СН 2 4 8 6
1 СН 5 СН 2 4 8 6

 2 4 5 2 СН2 4 СН2 3 7
2 4 5 2 СН2 4 СН2 3 7
3 3 СН2






 пропеллан или бицикло[2.2.1]гептан бицикло[3.3.1]нонан
пропеллан или бицикло[2.2.1]гептан бицикло[3.3.1]нонан
2 1 7
8 6
3 4 5
спиран или спиро[3.4]октан
Последнее соединение относится к спиросоединениям, имеющим общую точку соприкосновения (общий углеродный атом)..
МОНОЦИКЛЫ
Моноциклами называются соединения, имеющие один цикл.
Циклы, содержащие число углеродных атомов (С3-С4), называются малыми циклами, (С5, С6, С7) особенными, (С8- С12) – средними, а (С12 и выше) – большими циклами.
Химические свойства
Химические свойства циклоалканов протекают по трем направлениям:
1) замещение водородных атомов при атомах углерода;
2) раскрытие кольца;
3) превращения кольца (сужение, расширение).
 2018-01-21
2018-01-21 384
384








