Рефрактометрия - это метод исследования веществ, основанный на определении показателя преломления и некоторых его функций. Рефрактометрия применяется для идентификации химических соединений, количественного и структурного анализа, определения физико-химических параметров веществ.
Показатель преломления n, представляет собой отношение скоростей света в граничащих средах. Для жидкостей и твердых тел n обычно определяют относительно воздуха, а для газов - относительно вакуума. Значения n зависят от длины волны l света и температуры, которые указывают соответственно в подстрочном и надстрочном индексах. Например, показатель преломления при 20°С для D-линии спектра натрия (l = 589 нм) - nD20. Часто используют также линии спектра водорода С (l = 656 нм) и F (l = 486 нм). В случае газов необходимо также учитывать зависимость n от давления (указывать его или приводить данные к нормальному давлению).
В идеальных системах (образующихся без изменения объема и поляризуемости компонентов) зависимость показателя преломления от состава близка к линейной, если состав выражен в объемных долях (процентах)
|
|
|
n=n1V1+n2V2,
где n, n1,n2 - показатели преломления смеси и компонентов,
V1 и V2 - объемные доли компонентов (V1 + V2 = 1).
Для рефрактометрии растворов в широких диапазонах концентраций пользуются таблицами или эмпирическими формулами, важнейшие из которых (для растворов сахарозы, этанола и др.) утверждаются международными соглашениями и лежат в основе построения шкал специализированных рефрактометров для анализа промышленной и сельскохозяйственной продукции.
Влияние температуры на показатель преломления определяется двумя факторами: изменением количества частиц жидкости в единице объема и зависимостью поляризуемости молекул от температуры. Второй фактор становится существенным лишь при очень большом изменении температуры.
Температурный коэффициент показателя преломления пропорционален температурному коэффициенту плотности. Поскольку все жидкости при нагревании расширяются, то их показатели преломления уменьшаются при повышении температуры. Температурный коэффициент зависит от величины температуры жидкости, но в небольших температурных интервалах может считаться постоянным.
Для подавляющего большинства жидкостей температурный коэффициент лежит в узких пределах от –0,0004 до –0,0006 1/град. Важным исключением является вода и разбавленные водные растворы (–0,0001), глицерин (–0,0002), гликоль (–0,00026).
Линейная экстраполяция показателя преломления допустима на небольшие разности температур (10 – 20°С). Точное определение показателя преломления в широких температурных интервалах производится по эмпирическим формулам вида: nt=n0+at+bt2+…
|
|
|
Давление влияет на показатель преломления жидкостей значительно меньше, чем температура. При изменении давления на 1 атм. изменение n составляет для воды 1,48?10-5, для спирта 3,95?10-5, для бензола 4,8?10-5. То есть изменение температуры на 1°С влияет на показатель преломления жидкости примерно также, как изменение давления на 10 атм.
Обычно n жидких и твердых тел рефрактометрией определяют с точностью до 0,0001 на рефрактометрах, в которых измеряют предельные углы полного внутреннего отражения. Наиболее распространены рефрактометры Аббе с призменными блоками и компенсаторами дисперсии, позволяющие определять nD в "белом" свете по шкале или цифровому индикатору. Максимальная точность абсолютных измерений (10 -10) достигается на гониометрах с помощью методов отклонения лучей призмой из исследуемого материала. Для измерения n газов наиболее удобны интерференционные методы. Интерферометры используют также для точного (до 10 -7) определения разностей n растворов. Для этой же цели служат дифференциальные рефрактометры, основанные на отклонении лучей системой двух-трех полых призм.
Автоматические рефрактометры для непрерывной регистрации n в потоках жидкостей используют на производствах при контроле технологических процессов и автоматическом управлении ими, а также в лабораториях для контроля ректификации и как универсальные детекторы жидкостных хроматографов.
3.Второе начало термодинамики — физический принцип, накладывающий ограничение на направление процессов передачи тепла между телами.
Второе начало термодинамики запрещает так называемые вечные двигатели второго рода, показывая, что коэффициент полезного действия не может равняться единице, поскольку для кругового процесса температура холодильника не может равняться абсолютному нулю (невозможно построить замкнутый цикл, проходящий через точку с нулевой температурой).
Второе начало термодинамики является постулатом, не доказываемым в рамках термодинамики. Оно было создано на основе обобщения опытных фактов и получило многочисленные экспериментальные подтверждения.
Свободная энергия Гиббса — это величина, показывающая изменение энергии в ходе химической реакции и дающая таким образом ответ на вопрос о принципиальной возможности протекания химической реакции; это термодинамический потенциал следующего вида:
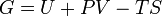
Энергию Гиббса можно понимать как полную химическую энергию системы (кристалла, жидкости и т. д.)
Связь с химическим потенциалом
Используя свойства экстенсивности термодинамических потенциалов, математическим следствием которых является соотношение Гиббса-Дюгема, можно показать, что химический потенциал для системы с одним типом частиц есть отношение энергии Гиббса к числу частиц в системе:
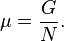
Если система состоит из частиц нескольких сортов i с числом N_i частиц каждого сорта, то соотношения Гиббса-Дюгема приводят к выражению
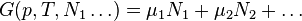
Химический потенциал применяется при анализе систем с переменным числом частиц, а также при изучении фазовых переходов. Так, исходя из соотношений Гиббса-Дюгема и из условий равенства химических потенциалов 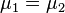 находящихся в равновесии друг с другом фаз, можно получить уравнение Клапейрона-Клаузиуса, определяющее линию сосуществования двух фаз в координатах (p,T) через термодинамические параметры (удельные объёмы) фаз и теплоту перехода между фазами.
находящихся в равновесии друг с другом фаз, можно получить уравнение Клапейрона-Клаузиуса, определяющее линию сосуществования двух фаз в координатах (p,T) через термодинамические параметры (удельные объёмы) фаз и теплоту перехода между фазами.
Энергия Гиббса и направление протекания реакции[править | править вики-текст]
В химических процессах одновременно действуют два противоположных фактора — энтропийный 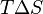 и энтальпийный
и энтальпийный 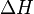 Суммарный эффект этих противоположных факторов в процессах, протекающих при постоянном давлении и температуре, определяет изменение энергии Гиббса (G):
Суммарный эффект этих противоположных факторов в процессах, протекающих при постоянном давлении и температуре, определяет изменение энергии Гиббса (G):
|
|
|
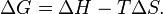
Из этого выражения следует, что 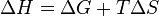 то есть некоторое количество теплоты расходуется на увеличение энтропии
то есть некоторое количество теплоты расходуется на увеличение энтропии 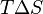 эта часть энергии потеряна для совершения полезной работы (рассеивается в окружающую среду в виде тепла), её часто называют связанной энергией. Другая часть теплоты
эта часть энергии потеряна для совершения полезной работы (рассеивается в окружающую среду в виде тепла), её часто называют связанной энергией. Другая часть теплоты 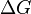 может быть использована для совершения работы, поэтому энергию Гиббса часто называют также свободной энергией.
может быть использована для совершения работы, поэтому энергию Гиббса часто называют также свободной энергией.
Характер изменения энергии Гиббса позволяет судить о принципиальной возможности осуществления процесса. При 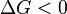 процесс может протекать, при
процесс может протекать, при 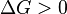 процесс протекать не может (иными словами, если энергия Гиббса в исходном состоянии системы больше, чем в конечном, то процесс принципиально может протекать, если наоборот — то не может). Если же
процесс протекать не может (иными словами, если энергия Гиббса в исходном состоянии системы больше, чем в конечном, то процесс принципиально может протекать, если наоборот — то не может). Если же 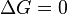 , то система находится в состоянии химического равновесия.
, то система находится в состоянии химического равновесия.
Обратите внимание, что речь идёт исключительно о принципиальной возможности протекания реакции. В реальных же условиях реакция может не начинаться и при соблюдении неравенства 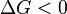 (по кинетическим причинам).
(по кинетическим причинам).
Существует полезное соотношение, связывающее изменение свободной энергии Гиббса 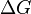 в ходе химической реакции с её константой равновесия ~K:
в ходе химической реакции с её константой равновесия ~K:
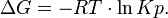
где Кр - равновесная константа по давлению (только в атмосферах),
Вообще говоря, любая реакция может быть рассмотрена как обратимая (даже если на практике она таковой не является). При этом константа равновесия определяется как
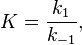
где 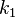 — константа скорости прямой реакции,
— константа скорости прямой реакции, 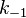 — константа скорости обратной реакции.
— константа скорости обратной реакции.
Свобо́дная эне́ргия Гельмго́льца (или просто свобо́дная эне́ргия) — термодинамический потенциал, убыль которого в квазистатическом изотермическом процессе равна работе, совершённой системой над внешними телами
Свободная энергия Гельмгольца для системы с постоянным числом частиц определяется так:
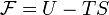 где U — внутренняя энергия, T — абсолютная температура, S — энтропия.
где U — внутренняя энергия, T — абсолютная температура, S — энтропия.
Отсюда дифференциал свободной энергии равен:
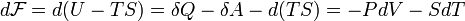 Видно, что это выражение является полным дифференциалом относительно независимых переменных T и V. Поэтому часто свободную энергию Гельмгольца для равновесного состояния выражают как функцию
Видно, что это выражение является полным дифференциалом относительно независимых переменных T и V. Поэтому часто свободную энергию Гельмгольца для равновесного состояния выражают как функцию 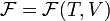
|
|
|
Для системы с переменным числом частиц дифференциал свободной энергии Гельмгольца записывается так:
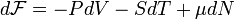 где
где 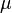 — химический потенциал, а N — число частиц в системе. При этом свободная энергия Гельмгольца для равновесного состояния записывается как функция
— химический потенциал, а N — число частиц в системе. При этом свободная энергия Гельмгольца для равновесного состояния записывается как функция 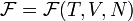
В соответствии с рекомендациями ИЮПАК энергию Гельмгольца в химической термодинамике можно также обозначать как A
В приложениях «свободной энергией» иногда называют не свободную энергию Гельмгольца, а энергию Гиббса. Это связано с тем, что энергия Гиббса также является мерой максимальной работы, но в данном случае рассматривается только работа над внешними телами, исключая среду:
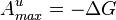 Где G энергия Гибса
Где G энергия Гибса
Билет
вопрос 1.Эксика́тор — сосуд, в котором поддерживается определённая влажность воздуха (обычно близкая к нулю), изготовленный из толстого стекла или пластика. Плоскость соединения с крышкой для достижения герметичности смазывается специальной смазкой. Используется для медленного высушивания при комнатной температуре, хранения гигроскопичных соединений, при гравиметрии, когда важно не допустить насыщения исследуемых веществ неопределённым количеством воды из воздуха, а также в почвоведении для снятия кривой ОГХ. Для некоторых целей возможно создание вакуума внутри эксикатора.Эксикатор имеет особую форму для размещения решётчатого фарфорового поддона на который устанавливаются бюксы. На дно эксикатора помещается гигроскопичное вещество для осушения или раствор, поддерживающий определённое парциальное давление водяных паров.
вопрос 2. Монохромное излучение— электромагнитное излучение, обладающее очень малым разбросом частот, в идеале — одной частотой (длиной волны). Монохроматическое излучение формируется в системах, в которых существует только один разрешённый электронный переход из возбуждённого в основное состояние.
Монохроматизация света достигается применением светофильтров. Пучок света, поступающий в прибор, предварительно пропускают через светофильтр. Так как светофильтр обладает избирательным светопоглоще-нием, то он пропускает свет только в узком интервале длин волн. Цвет самого светофильтра соответствует участку спектра, который он пропускает, и является дополнительным к цвету поглощаемого света. Ширина участка пропускаемого света для различных светофильтров меняется в пределах от 100 до 20 нм.
Светофильтр в оптике, технике — оптическое устройство, которое служит для подавления (выделения) части спектра электромагнитного излучения.
Защитный фильтр
Нейтральный фильтр Служит для снижения эффективной светосилы объектива без изменения геометрической, а также для снижения эффективной светосилы объектива, не имеющего диафрагмы.
Градиентный фильтр Выравнивает яркость сцены, притемняя или меняя цвет части изображения.
Спектральные (цветные)
-Ультрафиолетовый фильтр (бесцветный фильтр) — предназначен для снижения воздействия ультрафиолетовой части спектра
-Инфракрасный фильтр — пропускает инфракрасную часть спектра, задерживая все остальные части спектра.
-Флуоресцентный фильтр — специальный корректирующий светофильтр, приводящий освещение лампами дневного света к балансу, близкому к лампам накаливания.
Аддитивные светофильтры — цветоделительные зональные светофильтры, выделяющие из исходного светового потока белого света трёх пространственно разделённых (с помощью других оптических элементов) потоков: синего, зелёного и красного
Субтрактивные фильтры
Тепловой фильтр,теплофильтр — избирательно поглощает или отражает инфракрасное излучение и пропускает с малыми потерями диапазон видимого света.
вопрос 3. Термодинами́ческие потенциа́лы — внутренняя энергия U, рассматриваемая как функция энтропии S и обобщённых координат 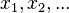 (объёма системы, площади поверхности раздела фаз, длины упругого стержня или пружины, поляризации диэлектрика, намагниченности магнетика, масс компонентов системы и др.), и термодинамические характеристические функции, получаемые посредством применения преобразования Лежандра к внутренней энергии
(объёма системы, площади поверхности раздела фаз, длины упругого стержня или пружины, поляризации диэлектрика, намагниченности магнетика, масс компонентов системы и др.), и термодинамические характеристические функции, получаемые посредством применения преобразования Лежандра к внутренней энергии
Цель введения термодинамических потенциалов — использование такого набора естественных независимых переменных, описывающих состояние термодинамической системы, который наиболее удобен в конкретной ситуации, с сохранением тех преимуществ, которые даёт применение характеристических функций с размерностью энергии. В частности, убыль термодинамических потенциалов в равновесных процессах, протекающих при постоянстве значений соответствующих естественных переменных, равна полезной внешней работе.
Термодинамические потенциалы были введены У. Гиббсом, говорившим о «фундаментальных уравнениях; термин термодинамический потенциал принадлежит Пьеру Дюгему.
Выделяют следующие термодинамические потенциалы:
внутренняя энергия
энтальпия
свободная энергия Гельмгольца
потенциал Гиббса
большой термодинамический потенциал
вопрос 4. Коллоидные системы, коллоиды — дисперсные системы, промежуточные между истинными растворами и грубодисперсными системами — взвесями, в которых дискретные частицы, капли или пузырьки дисперсной фазы, имеющие размер хотя бы в одном из измерений от 1 до 100 нм, распределены в дисперсионной среде, обычно непрерывной, отличающейся от первой по составу или агрегатному состоянию. В свободнодисперсных коллоидных системах (дымы, золи) частицы не выпадают в осадок.
Существует несколько классификаций коллоидных систем.
-Классификация по агрегатному состоянию дисперсионной среды. Пример туман дым молоко пемза бетон пыль
- Классификация по межфазному взаимодействию пример линейные кристалы
- Классификация по внутренней структуре частиц. Дисперсные системы по внутренней структуре частиц делятся на два основных класса
-- Высокомолекулярные соединения
-- Молекулярные коллоиды
 2018-01-21
2018-01-21 1066
1066







