Подобно тому, что передача тепла протекает только при разности температур, перенос вещества из одной фазы в другую осуществляется только при наличии разности концентраций, которая и является движущей силой процесса.
Рассмотрим статику процесса:

Как только фаза у и фаза х соприкасаются начинается переход компонента из фазы в фазу и его концентрация в фазе у будет падать.


В фазе х концентрация растет.
Процесс перехода массы из фазы в фазу происходит до тех пор, пока на границе перехода фаз не установится равные концентрации.


Состояние равновесия характеризуется равными скоростями перехода массы вещества из фазы в фазу. Такой переход возможен, если рабочая концентрация больше чем равновесная  . Именно эта концентрация показывает, в какую фазу идет переход.
. Именно эта концентрация показывает, в какую фазу идет переход.
На равновесные концентрации влияют внешние условия
Разница между концентрацией - чем она выше тем больше скорость массопередачи.
Количество переданной из фазы в фазу пропорционально поверхности раздела фаз.
|
|
|


Где  - кинетический коэффициент массопередачи.
- кинетический коэффициент массопередачи.

Для процесса массопередачи в газовой фазе движущая сила процесса может быть выражена через разность парциальных давлений

 - парциальное давление распределенного компонента в газе.
- парциальное давление распределенного компонента в газе.
 - парциальное давление распределяемого компонента в газе при его равновесии с жидкостью.
- парциальное давление распределяемого компонента в газе при его равновесии с жидкостью.
Закон Дальтона.
Под парциальным давлением понимается давление под которым он находился бы в отсутствие других компонентов, занимая весь объем.


Принимая во внимание основной закон для газов можно отношение  приравнять к
приравнять к  :
:


Т.к. моль любого газа занимает объем 22,4  , значит:
, значит:

Состояние равновесия имеет место при определении зависимости между концентрациями распределенного компонента в обеих фазах.
Любой концентрации компонента в фазе х соответствует его равновесная концентрация в фазе у.
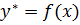 и наоборот
и наоборот 
Эти зависимости экспериментальные.
Отношения равновесных концентраций в одной фазе в такой же момент времени во второй фазе называется коэффициентом распределения(m)

Для идеальных систем зависимость между равновесными концентрациями в одной фазе и текущей в другой определяется законом Генри, который может быть записана через парциальные давления:

 - парциальное давление в фазе у
- парциальное давление в фазе у
 - константа Генри.
- константа Генри.
Или концентрацию:
Т.к 

Равновесная концентрация в фазе у пропорциональна рабочей концентрации в фазе х.
Закон Генри существует для идеальных систем, в этом случае равновесная линия будет прямой, выходящей из начала координат.
Для не идеальных систем линия равновесия – кривая.
|
|
|
Зная линию равновесия для конкретной системы и рабочие концентрации фаз можно определить направление и величину движущей силы? в любой точке аппарата. По этим величинам может быть рассчитана средняя движущая сила процесса(см. уравнение массопередачи).
За поверхность массопередачи берется поверхность контакта фаз.
 Материальный баланс. Рабочая линия.
Материальный баланс. Рабочая линия.
Рабочие концентрации распределенного вещества в аппарате не равны равновесным. Зависимость между рабочими концентрациями изображается линией- рабочей линией.
Уравнение рабочей линии процесса может быть получено из уравнения материального баланса массообменного аппарата. Массообменный аппарат в процессах абсорбции, ректификации, перегонки представляет из себя аппарат колонного типа.
 -количество подаваемой жидкости;
-количество подаваемой жидкости;
 - концентрация в ней растворенного компонента.
- концентрация в ней растворенного компонента.
 2017-11-01
2017-11-01 823
823








