Анод - растворимый (серебряный сплав).
Катод - Ag (чистое).
Электролит - водный раствор (AgNO3 + HNO3) 10- 20 г/л.
 Ag AgNO3, HNO3, Ag
Ag AgNO3, HNO3, Ag
(катод) H2O, примеси с примесями
(анод)
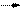 На А: Ag Ag++ e; j Ag/Ag+ = + 0,799 В.
На А: Ag Ag++ e; j Ag/Ag+ = + 0,799 В.
Au, Pt, Pd переходят в шлам, так как более электроположительны.
j 0 H2O/O2 > j Ag ,
!!! 2H2O 4H++O2+4e,
j 0 = +1,23 B - реакция невозможна!!!
На А: Cu, Pt, Bi, Zn, Fe и другие, более электроотрицательные, чем Ag переходят в раствор.
На К: основной процесс
 Ag+ + e Ag.
Ag+ + e Ag.
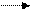 Выделение Н по реакции: 2H+ +2e H2 ; j0 = 0; невозможно,
Выделение Н по реакции: 2H+ +2e H2 ; j0 = 0; невозможно,
так как j 0 Ag > j H2 .
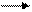 Возможно восстановление: NO3- + 2H+ + e NO2 + H2O;
Возможно восстановление: NO3- + 2H+ + e NO2 + H2O;
 NO3- + 4H+ + 3e NO + 2H2O;
NO3- + 4H+ + 3e NO + 2H2O;
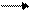 2NO3- + 10H+ + 8e N2O+ 5H2O.
2NO3- + 10H+ + 8e N2O+ 5H2O.
Эти реакции возможны при повышенной кислотности раствора (HNO3 необходима для повышения электропроводности электролита).
Чрезмерное повышение рН приводит к уменьшению выхода по току Ag. Кроме того, увеличивается растворимость Pt и Pd на аноде. Иногда для повышения электропроводности вводят HNO3 (до 15 г/л).
 2014-01-25
2014-01-25 681
681








