Характеристика связей в молекуле карбоновой кислоты
| тип связи | длина связи, нм |
| С = О | 0,123 |
| С - ОН | 0,136 |
| О - Н | 0,095 |
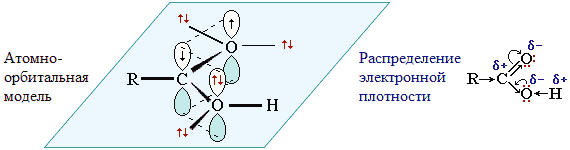
Атом углерода в карбоксильной группе находится в состоянии sp2-гибридизации. Три sp2-гибридные орбитали идут на образование связей с соседними атомами кислорода и углерода. Негибридизованная р-орбиталь участвует в образовании π-связи в оксо-(карбонильной) группе. Двойная связь С = О длиннее, чем в альдегидах, а одинарная связь С-ОН, наоборот, короче, чем в спиртах. В результате этого в карбоксильной группе возникает π-р-сопряжение. р-орбиталь атома кислорода группы ОН взаимодействует с р-орбиталью атома углерода карбонильной группы С=О.
Исходя из особенностей строения карбоксильной группы можно сделать следующие выводы:
1. Связь С=О поляризована (электронная плотность смещена к кислороду (вследствие более высокой электроотрицательности последнего). На атоме кислорода оксогруппы возникает избыток электронной плотности (δ-), на атоме углерода - недостаток электронной плотности (δ+). Следовательно, атом углерода смещает в свою сторону электронную плотность по связи С – ОН. Связь
|
|
|
О – Н поляризуется, и водород способен к отщеплению в виде протона, что указывает на кислотные свойства карбоновых кислот (реакции Se).
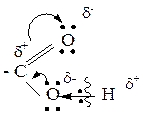
2. Связь С-ОН так же поляризована, т.е. электронная плотность по данной связи смещается в сторону кислорода группы ОН. Следовательно, может происходить разрыв связи С-ОН (реакции Sn).
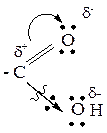
3. Карбоксильная группа, в целом, является электроноакцепторной группой и способна смещать электронную плотность от соседнего атома углерода (α-углеродного атома). Соответственно, электронная плотность по связи С-Н у α-углеродного атома смещается к углероду и водород приобретает подвижность и способен к отщеплению (реакции Se в углеводородном радикале).
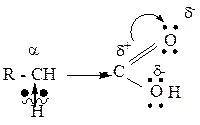
 2014-01-31
2014-01-31 1213
1213








